题目内容
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
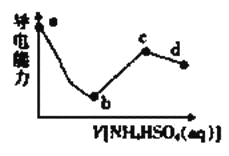
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
【答案】A
【解析】
假设丙、丁中的CO、H2O(g)全部转化为CO2、H2,再与甲、乙比较:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
丙开始时 0mol 0mol anol anol
丙假设全转化 anol anol 0mol 0mol
丁开始时 amol 0mol amol amol
丁假设全转化 2amol amol 0mol 0mol
通过比较,甲、丙的数值一样,乙、丁的数值一样,则说明甲和丙属于等效平衡,乙和丁为等效平衡,因为乙或丁相当于比甲多加入二氧化碳,则增大反应物的量,平衡正向移动,则生成一氧化碳的物质的量比甲多,故选A。
【点晴】
采用极端假设法是解决本题的关键;在相同温度和压强下的可逆反应,反应后气体体积不变,按方程式的化学计量关系转化为方程式同一边的物质进行分析;本题还涉及等效平衡,等效平衡是一种解决问题的模型,对复杂的对比问题若设置出等效平衡模型,然后改变条件平衡移动,问题就迎刃而解。

【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1