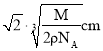题目内容
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
【答案】D
【解析】
A.根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;平衡常数只与温度有关,温度不变,平衡常数不变;
B.增大压强,平衡向气体体积减小的方向移动;
C.根据v=![]() 进行计算;
进行计算;
D.计算出此时的Qc与K比较,判断反应进行的方向。
PCl5(g)![]() PCl3(g)+Cl2(g),
PCl3(g)+Cl2(g),
A.I中K=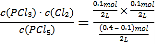 ≈0.03mol/L,平衡常数只与温度有关,温度不变,平衡常数不变,则容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=
≈0.03mol/L,平衡常数只与温度有关,温度不变,平衡常数不变,则容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=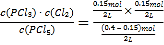 =0.045mol/L,即平衡常数K:容器Ⅱ<容器Ⅲ,A错误;
=0.045mol/L,即平衡常数K:容器Ⅱ<容器Ⅲ,A错误;
B.容器Ⅱ与容器Ⅰ相比,相当于增大压强,增大压强,化学平衡气体体积减小的逆反应方向移动,PCl5的转化率减小,即PCl5的转化率:容器Ⅱ<容器Ⅰ,B错误;
C.对于容器I,反应到达平衡时,反应的PCl5的物质的量为0.1mol,故v(PCl5)=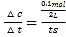 =
=![]() mol/(Ls),C错误;
mol/(Ls),C错误;
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则此时Qc= =0.075mol/L>0.045mol/L,所以化学平衡向逆反应方向移动,D正确;
=0.075mol/L>0.045mol/L,所以化学平衡向逆反应方向移动,D正确;
故合理选项是D。

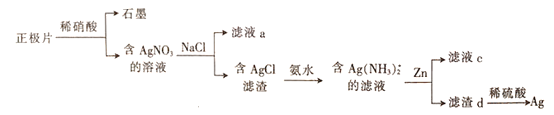
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

有关物质性质如下表:
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器a的名称是________;与a相比,仪器b的优点是_____________________________。
(2)装置B中盛有的试剂是____________;实验过程中装置D的导管一直没入液面下的必要性是___________________________________________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和________________________ 。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)检验产品中是否含有Fe3+的试剂名称是_________ 。
(7)本实验制得15.3g甘氨酸亚铁(M=204g/mol),则其产率是_____%。