��Ŀ����
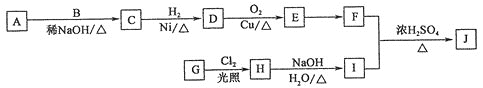
����Ŀ�������������дٽ�����֬�������Ĺ��ܣ����������Ʒ���֢���ϳ�ij��������J(![]() )��������ͼ��ʾ��A��B��E�еĺ���������������ͬ��A��B�˴Ź���������2���壬A��Է���������B�Ĵ�
)��������ͼ��ʾ��A��B��E�еĺ���������������ͬ��A��B�˴Ź���������2���壬A��Է���������B�Ĵ�
��֪��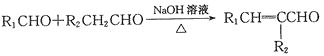
��J�й����ų��ǻ����________��G��H�ķ�Ӧ����Ϊ________��
��D�Ľṹ��ʽΪ______________��A��������________________��
��д��H��I�Ļ�ѧ��Ӧ����ʽ��_______________________________________________��
��E�ж���ͬ���칹�壬��������������������________�֣�д���˴Ź���������3��������ʵĽṹ��ʽ��__________________��
�������к���������������̼��˫��
������ȩΪ����ԭ�ϣ���������Ӧ�Ʊ�![]() �ȶ��ᣬ�����������﷽ʽ��д����Ӧ������ͼ��____________________________________��
�ȶ��ᣬ�����������﷽ʽ��д����Ӧ������ͼ��____________________________________��
���𰸡��Ѽ� ���� ȡ����Ӧ ![]() 2��
2��![]() ������ȩ
������ȩ ![]() +2NaOH
+2NaOH![]()
![]()
![]()
![]()
![]() CH3CHO
CH3CHO ![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CHClCHO
CH3CH2CHClCHO![]() CH3CH2CHClCOOH
CH3CH2CHClCOOH
��������
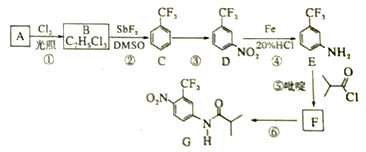
��G��H�ķ�Ӧ������֪���÷�ӦΪȡ����Ӧ��H��I��������֪��I�к����ǻ������J�Ľṹ��ʽ��֪FΪC6H13COOH�� IΪ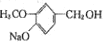 ����HΪ
����HΪ![]() ������֪��G����ΪA��B��E�еĺ���������������ͬ��A��B�˴Ź���������2���壬A��Է���������B�Ĵ�A��C������֪��Ϣ�ķ�Ӧ����֪A��B��Ϊȩ������AΪ(CH3)3CCHO��BΪCH3CHO��CΪ(CH3)3CCH=CHCHO��DΪ(CH3)3CCH2CH2CH2OH��EΪ(CH3)3CCH2CH2CHO��FΪ(CH3)3CCH2CH2COOH��
������֪��G����ΪA��B��E�еĺ���������������ͬ��A��B�˴Ź���������2���壬A��Է���������B�Ĵ�A��C������֪��Ϣ�ķ�Ӧ����֪A��B��Ϊȩ������AΪ(CH3)3CCHO��BΪCH3CHO��CΪ(CH3)3CCH=CHCHO��DΪ(CH3)3CCH2CH2CH2OH��EΪ(CH3)3CCH2CH2CHO��FΪ(CH3)3CCH2CH2COOH��
�Ÿ���J�Ľṹ��ʽ��֪���еĹ����ţ�����G��H�����ͷ�Ӧ��ɵ÷�Ӧ���͡�
�Ƹ���ǰ������ó�D�Ľṹ��ʽ��A�Ľṹ��ʽ��
��H��I��ˮ�ⷴӦ�⣬���з��ǻ���NaOH���кͷ�Ӧ���õ���ѧ��Ӧ����ʽ��
��E�ж���ͬ���칹�壬�ٷ����к������������ں���̼��˫�����ź���ȩ�����ƺ����ʻ�ʱ���ٸ��ݷ���ͬ���칹������д��
������ȩΪ����ԭ�ϣ��ȷ�����֪��Ϣ�ķ�Ӧ���ڷ�����HCl�ļӳɷ�Ӧ���������ȩ�����ɡ�
�Ÿ���J�Ľṹ��ʽ��֪���еĹ����ų��ǻ�����Ѽ���������G��H��������ȡ����Ӧ���ʴ�Ϊ���Ѽ���������ȡ����Ӧ��
�Ƹ������Ϸ�����֪D�Ľṹ��ʽΪ(CH3)3CCH2CH2CH2OH��A�Ľṹ��ʽΪ(CH3)3CCHO��A������Ϊ2��![]() ������ȩ���ʴ�Ϊ��(CH3)3CCH2CH2CH2OH��2��
������ȩ���ʴ�Ϊ��(CH3)3CCH2CH2CH2OH��2��![]() ������ȩ��
������ȩ��
��H��I��ˮ�ⷴӦ�⣬���з��ǻ���NaOH���кͷ�Ӧ����ѧ��Ӧ����ʽΪ![]()
![]()
![]()
![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]()
![]()
![]()
![]() ��
��
��E�ж���ͬ���칹�壬�ٷ����к������������ں���̼��˫�����ź���ȩ�����ɿ�����CH3CH2CH2CH2CH2CHO������һ����CH3����4��λ�ã���ΪCH3CH2CH2CH2CHO������һ����CH2CH3����2��λ�ã��Ƶ������ʻ�ʱ���ɿ�����CH3CH2CH2CH2CH2CH2CH3�ϳ����˵ļ����⣬����һ��CH2��Ϊ�ʻ����������3�֣���һ����4+2+3=9�֣��˴Ź���������3��������ʵĽṹ��ʽ��![]() ���ʴ�Ϊ��9��
���ʴ�Ϊ��9��![]() ��
��
������ȩΪ����ԭ�ϣ��ȷ�����֪��Ϣ�ķ�Ӧ���ڷ�����HCl�ļӳɷ�Ӧ���������ȩ�����ɡ���Ӧ������ͼ��CH3CHO ![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CHClCHO
CH3CH2CHClCHO![]() CH3CH2CHClCOOH���ʴ�Ϊ��CH3CHO
CH3CH2CHClCOOH���ʴ�Ϊ��CH3CHO ![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CHClCHO
CH3CH2CHClCHO![]() CH3CH2CHClCOOH��
CH3CH2CHClCOOH��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�����Ŀ��������������Ӱ�����ǵ��������������е���������������������������������Ҫԭ��֮һ������������������������ж��ַ�����
��1��������Ԫ�طǽ����Խ�ǿ����_____��(��Ԫ�ط��Żش�)
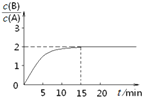
��2��NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������Ӧԭ����ͼ1��ʾ��
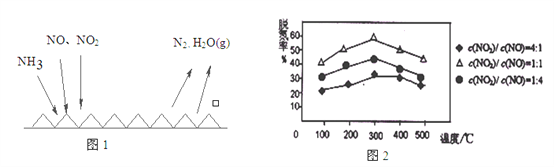
����ͼ1��֪SCR�����е�������Ϊ��_________________��
����Fe������ʱ���ڰ�������������£���ͬc(NO)/c(NO2)��Ӧ���ѵ�����ͼ2��ʾ��Ч����ѵ�c(NO)/ c(NO2)=_________��
��3�����᳧���������ռ����շ�������������(NO��NO2)β������������(NO��NO2)���ռ�������գ�����ΪNaNO2��NaNO3��H2O�����к�0.5mol���������β����ǡ�ñ�һ�������25%NaOH��Һ(�ܶ�1.28g/cm3)��ȫ���ա���֪��Ӧ����Һ�к���0.35mo1NaNO2����β����NO��NO2�����ʵ���֮��Ϊ______��(��֪:2NO2+2NaOH=NaNO3+NaNO2+H2O��NO+NO2+2NaOH=2NaNO2+H2O)
��4���ֽ�һ����������ͭ�Ļ�����Ϊ��������4�ݣ��ֱ�����Ũ�Ȳ�ͬ�����ϡ����[���跴Ӧ��ϡ����Ļ�ԭ����ֻ��NO)�����������ڱ�״���µ������ʣ�������������±�:
����������mL) | 100 | 200 | 300 | 400 |
ʣ�������g) | 18.0 | 9.6 | 0 | 0 |
�ų�����������mL) | 2240 | 4480 | 6720 |
����ԭ�����������ͭ�����ʵ�����Ϊ_______________��
����Ŀ������ͬ�¶Ⱥ�ѹǿ�£��Է�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
| CO2 | H2 | CO | H2O |
�� | amol | amol | 0mol | 0mol |
�� | 2amol | amol | 0mol | 0mol |
�� | 0mol | 0mol | amol | amol |
�� | amol | 0mol | amol | amol |
������������ﵽƽ���n(CO)�Ĵ�С˳����
A. �ң�����������B. �ң������ף���
C. �����ң�������D. ���������ң���
����Ŀ�������ѧ���������ɫ���������룺�Ѻ��д���CO2�Ŀ�������̼�����Һ�У��ٰ�CO2����Һ����ȡ��������ʹ֮��������Ӧ���ɿ�������Դ�״����乤��������ͼ��ʾ��
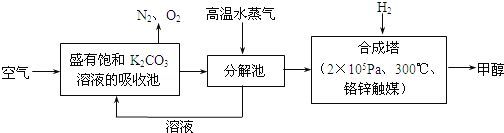
��1��д���ֽ���з�Ӧ�Ļ�ѧ����ʽΪ_______________��
��2���ںϳ����У�����4.4kg CO2������H2ǡ����ȫ��Ӧ��������̬��ˮ�ͼ״����ɷų�4947kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ_______________��
��3����֪�ϳ����еķ�Ӧ�ǿ���ģ�����ƽ���ƶ�ԭ��������������ԭ������ת������ʵ�������в���300����¶ȣ���ԭ�������_______________��
��4������ɫ���������������г��������ʵ���ѭ����������������������������ѭ�������������ʳ�̼�����Һ�⣬������________(��ѧʽ)��
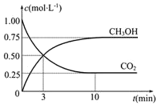
��5��300��ʱ����CO��H2��1:3������ȳ����ܱ������У�CO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ������ͼʾ�ش��������⣺
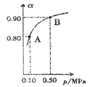
���������������䣬��A������ѹ����ԭ����һ�룬һ��ʱ���Ӧ�ٴ�ƽ���ǣ���ԭƽ��Ƚ�����˵����ȷ����________��
A��CO2��Ũ�ȼ�С |
B������Ӧ���������淴Ӧ���ʼ�С |
C��CO2��H2�������Ϊ1:3 |
D��CH3OH������������� |
�ڽ�1.0molCO2��3.0molH2�������������ܱ������У�2minʱ��Ӧ�ﵽƽ�⣬��ʱ��ϵ��ѹǿΪ0.10MPa����H2��ʾ�ķ�Ӧ����Ϊ1.2mol/(L��min)�����ܱ������������____L��
��6���״�������ȼ�ϵ�ء�������������ҺΪ����ʵĸ�����Ӧʽ��__________����ת�Ƶĵ��ӵ����ʵ���Ϊ_______molʱ���μӷ�Ӧ�������������6.72L(��״����)��