��Ŀ����
����Ŀ��ij�¶��£� ��ӦH2(g)+CO2(g)![]() H2O(g)+CO(g)��ƽ�ⳣ��
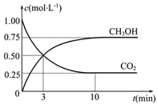
H2O(g)+CO(g)��ƽ�ⳣ��![]() �����¶����������Ϊ10 L�������ܱ������зֱ���뷴Ӧ���ʼ��������ͼ��ʾ�������жϲ���ȷ����
�����¶����������Ϊ10 L�������ܱ������зֱ���뷴Ӧ���ʼ��������ͼ��ʾ�������жϲ���ȷ����
��ʼ�� | �� | �� | �� |
H2 ��mol�� | 1 | 2 | 2 |
CO2��mol�� | 1 | 1 | 2 |
A.��Ӧ��ʼʱ�����еķ�Ӧ�������������еķ�Ӧ�������
B.ƽ��ʱ���ͱ���CO2��ת������ȣ�����60��
C.ƽ��ʱ,���У�2��ת���ʴ���60%
D.ƽ��ʱ�����У�(��2 ) ��0. 08 mol��L-1
���𰸡�C
��������
A����������������ʱ������Ӧ���Ũ�ȣ���Ӧ���ʼӿ죬��С��Ӧ���Ũ�ȣ���Ӧ���ʼ�С�������ڷ�Ӧ��ʼʱ����������Ũ����С����������Ũ�������˼��еķ�Ӧ�������������еķ�Ӧ������죬��ȷ��
B�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ���ס��������ʵ�Ũ�ȱ���ȣ�����ƽ��ʱ���ͱ���CO2��ת������ȣ��������H2��Ӧ�����ʵ�����x����ƽ��ʱ�����ʵ����ʵ����ֱ���:H2:((1-x)��CO2:((1-x)��H2O:x��CO��x��x2/(1-x)2=9/4�����x=0.6������������ʵ�ת���ʾ���60������ȷ��
C�������ң����������������䣬��H2Ũ�����������ƽ���ƶ�ԭ��������Ӧ���Ũ�ȣ�ƽ�������ƶ���ʹ�������ʵ�ת�������������ʵ�ת���ʽ��͡����ƽ��ʱ, ���У�2��ת����С��60%������
D�����ڼס��������ʵ�ת���ʶ���60%������ƽ��ʱ�����У�(��2 ) ��2mol��40%��10L="0." 08 mol��L-1����ȷ��

����Ŀ�������¶��£���10mL0.40mol/LH2O2 ��Һ�м�������FeCl3��Һ(����������������Һ����ı仯),��ͬʱ�̲������O2�����(������Ϊ��״����)�����ʾ��
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
������ʾ,��Ӧ���������У���2Fe3++H2O2��2Fe2++2H++O2����H2O2+2Fe2++2H+��2H2O+2Fe3+����Ӧ�����������仯��ͼ��ʾ������˵����ȷ����
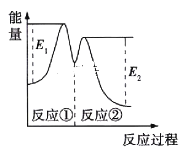
A. Fe2+�������������������ķֽ�����
B. ��Ӧ�١��ھ��Ƿ��ȷ�Ӧ
C. ��Ӧ2H2O2(aq)��2H2O(l)+O2(g)�����ȷ�Ӧ
D. 0��6min�ڵ�ƽ����Ӧ����v(H2O2)��3.33��10-2mol/(L��min)
����Ŀ������ͬ�¶Ⱥ�ѹǿ�£��Է�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
| CO2 | H2 | CO | H2O |
�� | amol | amol | 0mol | 0mol |
�� | 2amol | amol | 0mol | 0mol |
�� | 0mol | 0mol | amol | amol |
�� | amol | 0mol | amol | amol |
������������ﵽƽ���n(CO)�Ĵ�С˳����
A. �ң�����������B. �ң������ף���
C. �����ң�������D. ���������ң���
����Ŀ����![]() ��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��

ʵ���� | �¶ȣ�K�� | pH |
�� | 298 | 1 |
�� | 310 | 1 |
�� | 298 | 7 |
�� | 298 | 1 |
A.ʵ�����15min��M�Ľ�������Ϊ![]()
B.������������ͬ��ʵ��٢�˵�������¶ȣ�M������������
C.������������ͬ��ʵ��٢�֤��pHԽ�ߣ�Խ������M�Ľ���
D.������������ͬ��ʵ��٢�˵��M��Ũ��ԽС�����������Խ��