题目内容
1.同物质的量浓度同体积的Na2CO3和NaHCO3溶液中,分别加入足量等体积等浓度的盐酸,结果是( )| A. | Na2CO3产生的CO2多 | B. | NaHCO3产生的CO2多 | ||
| C. | NaHCO3的反应速率快 | D. | 二者产生CO2一样多 |
分析 由方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,产生的CO2一样多;Na2CO3与盐酸反应原理为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2,NaHCO3反应生成二氧化碳速率较快,以此解答该题.
解答 解:由方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,放出的二氧化碳的物质的量相同,则AB错误、D正确;
根据CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑可知,碳酸氢钠放出二氧化碳的速率快,则C正确.
故选CD.
点评 本题考查了碳酸氢钠、碳酸钠的化学性质,为高频考点,要求学生熟练掌握碳酸钠、碳酸氢钠的化学性质,试题基础性强,侧重对学生基础知识的巩固和训练,意在巩固学生的基础,提高学生的分析、理解能力,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
11.为方便某些计算,有人将98%的浓硫酸表示成下列形式,其中合理的是( )
| A. | H2SO4•H2O | B. | H2SO4•SO3 | C. | H2SO4•$\frac{1}{9}$H2O | D. | SO3•$\frac{10}{9}$H2O |
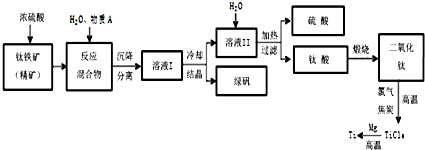
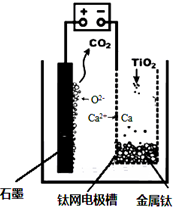 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O