题目内容
6.二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:(Ⅰ)CO(g)+2H2(g)═CH3OH (g)△H1=-90.1kJ•mol-1
(Ⅱ)CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1
水煤气变换反应:
(Ⅲ)CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-41.1kJ•mol-1
二甲醚合成反应:
(Ⅳ)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1.
分析 由所给热化学方程式可知,Ⅰ×2+Ⅳ可得到由H2和CO直接制备二甲醚的热化学方程式,以此解答该题.
解答 解:已知Ⅰ.CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ•mol-1
Ⅳ.2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ•mol-1
依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ•mol-1,
故答案为:2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握计算的思路,难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
16.关于NO的下列叙述,不正确的是( )
| A. | NO可以是某些含低价氮物质的氧化产物 | |
| B. | NO可以是某些含高价氮物质的还原产物 | |
| C. | 已知亚硝酸钠的化学式是NaNO2,则NO不是亚硝酸酐 | |
| D. | NO2和NO都是红棕色气体 |
17.X元素天然存在的一个原子中共有质子、中子及电子93个,其中35个粒子不带电,则X元素的该原子的相对原子质量约为( )
| A. | 35 | B. | 30 | C. | 64 | D. | 58 |
14.下列各组离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、CO32-、Cl- | B. | Na+、Mg2+、SO42-、OH- | ||
| C. | K+、Na+、OH-、Cl- | D. | Cu2+、Ba2+、Cl-、SO42- |
1.同物质的量浓度同体积的Na2CO3和NaHCO3溶液中,分别加入足量等体积等浓度的盐酸,结果是( )
| A. | Na2CO3产生的CO2多 | B. | NaHCO3产生的CO2多 | ||
| C. | NaHCO3的反应速率快 | D. | 二者产生CO2一样多 |
11.已知工业上真空炼铷的原理如下:2RbCl+Mg?MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是( )
| A. | 铷的金属活动性不如镁强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性不如Rb强 | |
| D. | 铷的单质状态较化合态更稳定 |
18.下列溶液一定显碱性的是( )
| A. | 溶液中无H+ | B. | 溶液中pH>7 | C. | 溶液中只有OH- | D. | 溶液中c(OH-)>c(H+) |
15.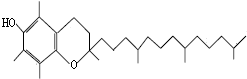 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
 蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )
蔬菜腐烂变质或烹调时焖煮时间太长,蔬菜中的硝酸盐会被维生素E还原成亚硝酸盐,会引起亚硝酸盐中毒.如图是维生素E的结构简式.下列说法中不正确的是( )| A. | 维生素E的化学式为:C29H50O2 | |
| B. | 维生素E的还原性主要是酚羟基表现出来,若被酯化后就不具有抗氧化活性 | |
| C. | 维生素E易溶于水和乙醇、苯等有机溶剂 | |
| D. | 维生素E虽含有酚羟基,但不能与溴水反应 |
16.用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
| A. | 铜$\stackrel{浓硫酸}{→}$硝酸铜 | B. | 铜$\stackrel{稀硫酸}{→}$硝酸铜 | ||
| C. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 | D. | Cu$\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |