题目内容
12.现有标准状况下的HCl气体11.2L,试关于其完成下列计算:(1)其物质的量为0.5mol;其中所含分子个数为3.01×1023;其质量为18.25g;
(2)若将其溶于水配成100mL溶液,求此溶液的物质的量浓度5mol/L,若所得溶液密度为1.1g/cm3,那其溶质的质量分数为16.59%(保留百分比中小数后2位).
分析 (1)气体的物质的量根据n=$\frac{V}{{V}_{m}}$、N=nNA、m=nM来计算;
(2)根据c=$\frac{n}{V}$来计算溶液的物质的量浓度,根据$\frac{溶质质量}{溶液质量}×100%$计算质量分数.
解答 解:(1)标况下,11.2LHCl气体的物质的量n=$\frac{V}{{V}_{m}}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,所含分子数N=n×NA=0.5mol×6.02×1023/mol=3.01×1023,m=nM=0.5mol×36.5g/mol=
18.25g,故答案为:0.5mol;3.01×1023;18.25g;
(2)溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.5mol}{0.1L}$=5mol/L,ρ=$\frac{18.25g}{100mL×1.1g/mL}×100%$=16.59%,故答案为:5mol/L;16.59%.
点评 本题考查了物质的量计算,题目难度不大,注意公式的应用.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
2.在一密闭容器中,反应mA(g)+nB(s)?3C(g)达到平衡时,测得C(A)为0.5mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3mol/L,则下列判断不正确的是( )
| A. | 混合气体密度一定减小 | B. | 平衡一定向逆反应方向移动 | ||
| C. | 化学计量数:m+n<3 | D. | 物质C的体积分数减小了 |
20.能用离子方程式:CO32-+2H+═CO2↑+H2O来表示的是( )
| A. | 碳酸钡与盐酸反应 | B. | 碳酸钾溶液与醋酸溶液反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
7.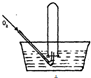 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
17.X元素天然存在的一个原子中共有质子、中子及电子93个,其中35个粒子不带电,则X元素的该原子的相对原子质量约为( )
| A. | 35 | B. | 30 | C. | 64 | D. | 58 |
1.同物质的量浓度同体积的Na2CO3和NaHCO3溶液中,分别加入足量等体积等浓度的盐酸,结果是( )
| A. | Na2CO3产生的CO2多 | B. | NaHCO3产生的CO2多 | ||
| C. | NaHCO3的反应速率快 | D. | 二者产生CO2一样多 |
2.不粘锅的内壁有一薄层为聚四氟乙烯的涂层,用不粘锅烹烧饭菜时不易粘锅、烧焦.下列关于聚四氟乙烯的说法正确的是( )
| A. | 聚四氟乙烯的化学活动性很强 | B. | 聚四氟乙烯分子中含有双键 | ||
| C. | 聚四氟乙烯的单体是不饱和烃 | D. | 聚四氟乙烯中氟的质量分数是76% |