题目内容
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
一定温度下,在一个固定容积的密闭容器中,可逆反应 A(S)+2B(g)?4C(g)△H>0达到平衡时,若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是( )
一定温度下,在一个固定容积的密闭容器中,可逆反应 A(S)+2B(g)?4C(g)△H>0达到平衡时,若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是( )
| A、增加A的物质的量 | B、加压 |
| C、升温 | D、使用催化剂 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:可逆反应 A(S)+2B(g)?4C(g)△H>0,是气体体积增大的吸热反应,依据化学平衡移动原理分析,若改变条件重新达到平衡后体系中C的质量分数增大,可以使平衡正向进行.
解答:
解:A、A为固体,增加A的物质的量对平衡无影响,故A错误;
B、加压,平衡向气体体积减小的分析进行,平衡那你先进行,C的质量分数减小,故B错误;
C、升高温度平衡向吸热反应方向进行,平衡正向进行,C的质量分数增大,故C正确;
D、使用催化剂改变反应速率,不改变化学平衡,C的质量分数不变,故D错误;
故选C.
B、加压,平衡向气体体积减小的分析进行,平衡那你先进行,C的质量分数减小,故B错误;
C、升高温度平衡向吸热反应方向进行,平衡正向进行,C的质量分数增大,故C正确;
D、使用催化剂改变反应速率,不改变化学平衡,C的质量分数不变,故D错误;
故选C.
点评:本题考查了化学平衡影响因素的分析判断,化学平衡移动原理的应用是解题关键,题目较简单.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、11.2L氧气中所含有的原子数为NA |
| B、同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
| C、物质的量浓度为0.5mol?L-1的MgCl2溶液中,含有Cl-个数为NA |
| D、54g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA |
下列离子方程式正确的是( )
| A、硫酸和氯氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| B、碳酸钠与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O |
| C、铁钉放入硫酸铁溶液中:Fe+Fe3+=2Fe2+ |
| D、Ca(NO3)2溶液和Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
下列措施不符合节能减排的是( )
| A、大力发展火力发电,解决电力紧张问题 |
| B、对杂草、生活垃圾等有机废弃物进行露天焚烧处理 |
| C、汽车安装尾气处理装置,减少大气污染 |
| D、在屋顶安装太阳能热水器为居民提供生活用热水 |
分类法是学习和研究化学的一种重要方法.下列分类不合理的是( )
| A、KOH和Na2CO3都属于碱 |
| B、K2CO3和KHCO3都属于盐 |
| C、H2SO4和HNO3都属于酸 |
| D、Na2O和SiO2都属于氧化物 |
关于由锌片、铜片和稀硫酸组成的原电池的说法中,正确的是( )
| A、锌片作负极,发生还原反应 |
| B、电流方向是由锌片流向铜片 |
| C、锌片质量逐渐减少,铜片上有气泡产生 |
| D、电解质溶液的氢离子浓度保持不变 |
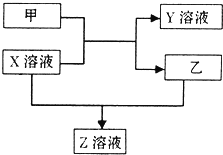 甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答:
甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体.X、Y、Z是化合物.X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红.它们之间有如图所示转化关系.请回答: