题目内容
5.向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下(温度为T),发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )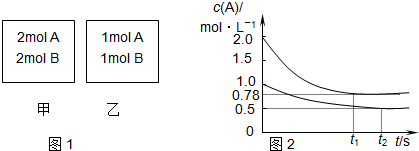
| A. | x=1 | |
| B. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 | |
| C. | 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中:0.78 mol•L-1<c(A)<1.56 mol•L-1 | |
| D. | 若甲容器为等压可变容器,向甲中充入惰性气体,则c(A)减小,平衡正向移动,v(正)、v(逆)减 |
分析 由图象可知平衡时,甲容器平衡时,A的转化率为$\frac{2mol-0.78mol}{2mol}$=61%,乙容器内A的转化率为$\frac{0.5mol}{1mol}$=50%,甲容器内压强比乙容器内大,增大压强向正反应移动,增大压强平衡压强增大向着体积减小的方向移动,故:1+1>x,所以x=1,反应放热,升高温度,平衡逆向移动,甲容器为等压可变容器,向甲中充入惰性气体,应增大体积,平衡逆向移动,以此解答该题.
解答 解:A.由上述分析可知x=1,故A正确;
B.该反应为放热反应,将乙容器单独升温,平衡向吸热反应方向移动,即向逆反应方向移动,A的转化率比甲容器的转化率低,不可能使乙容器内各物质的体积分数与甲容器内的相同,故故B错误;
C.向甲容器中再充入2molA、2molB,可以等效为原平衡状态下压强增大一倍,平衡向正反应方向移动,A转化率增大,所以平衡时甲容器中c(A)小于2倍原平衡中的c(A),平衡移动目的是降低浓度增大趋势,但不能消除浓度增大,达新平衡时浓度比原平衡大,所以平衡时甲容器中0.78mol/L<c(A)<1.56mol/L,故C正确;
D.甲容器为等压可变容器,向甲中充入惰性气体,应增大体积,平衡逆向移动,故D错误.
故选AC.
点评 本题考查平衡图象、等效平衡、外界条件对平衡影响、平衡计算等,为高考常见题型,侧重考查学生的分析、计算能力,难度中等,根据图象计算平衡时转化率,确定x值是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.已知3.01×1023个X气体分子的质量为32g,则X气体的摩尔质量是( )
| A. | 16g | B. | 32 | C. | 64g/mol | D. | 32g/mol |
16.下面有关Na2CO3与NaHCO3的说法,错误的是( )
| A. | NaHCO3俗名小苏打 | |
| B. | 在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | 与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 | |
| D. | 热稳定性:NaHCO3<Na2CO3 |
13.下列关于溶液的配制说法不正确的是( )
| A. | 将质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸要用容量瓶配制 | |
| B. | 配制100mL1mol/L的氢氧化钠溶液,称量固体质量为4.0g | |
| C. | 容量瓶在定容时,若视线仰视,会使得配制出的溶液物质的量浓度偏小 | |
| D. | 容量瓶洗涤时,若瓶底上有少量蒸馏水,可不必烘干直接使用 |
20.在某恒温密闭容器中,投入一定量的A发生可逆反应:A(s)?B(g)+C(g),△H=-Q kJ/mol(Q>O).一段时间后反应达到平衡,然后缩小容器体积,重新达到平衡.下列分析不正确的是( )
| A. | 两次平衡时,C(g)的浓度相等 | |
| B. | 平衡时,单位时间内n(B)生成:n(C)消耗=1:1 | |
| C. | 若再向平衡体系中加入少量A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量 |
10.下列叙述正确的是( )
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| B. | 在溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀,证明原溶液中有Fe2+ | |
| C. | 向FeCl3溶液中滴加稀氨水,可制备Fe(OH)3胶体 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发、灼烧}{→}$无水FeCl3 |
 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.