题目内容
20.一种微粒的质子数和电子数分别与另一种微粒的质子数和电子数相同,则下列说法中错误的是( )| A. | 可能是不同的分子与原子 | B. | 可能是不同的离子 | ||
| C. | 可能是一种离子和一种分子 | D. | 可能是某位素的同位素原子 |
分析 构成物质的基本粒子有:分子、原子、离子,在分子和原子中质子数等于电子数,对于离子来说质子数与核外电子数是不相同的.
解答 解:A.两种不同的分子的质子数和电子数可能均相等,如:H2O分子和NH3分子都含有10个质子,10个电子,故A正确;
B.不同的离子的质子数和电子数可能均相等,如:F-和OH-,故B正确;
C.一种分子和一种离子的质子数和电子数不可能均相等,因为对于分子来说质子数和电子数是相等的,对于离子来说质子数和电子数是不相等的,所以一种分子和一种离子要么质子数相等,要么电子数相等,不可能质子数和电子数都相等,故C错误;
D.同位素原子的质子数和电子数肯定相等,如:12C、13C,故D正确.
故选C.
点评 本题主要考查了分子、离子中质子数和电子数的计算,难度不大,要熟记对于分子和原子来说质子数和电子数都相等,对于离子来说质子数与电子数不相等.

练习册系列答案
相关题目
11.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O═6Cu+SO2↑,关于该反应的说法中,正确的是( )
| A. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| B. | 该反应的氧化剂只有Cu2O | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | 每生成19.2gCu,反应中转移1.8mol电子 |
8.已知25°C时,某浓度NaCN(氰化钠)溶液pH=11,则下列有关说法中不正确的是( )
| A. | HCN的电离方程式:HCN?H++CN- | |
| B. | NaCN是一种弱电解质 | |
| C. | NaCN溶液中一定存在:c(Na+)>c(CN-) | |
| D. | 0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=0.1mol•L-1 |
5.下列物质与常用危险化学品的类别不对应的是( )
| A. | H2SO4----腐蚀品 | B. | CH4---易燃液体 | ||
| C. | 白磷---易自燃物品 | D. | HClO---氧化剂 |
12. 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
 图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | NaAlO2 | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | Al2O3 | 两性氧化物 | 氧化物 |
| D | 单质参与反应 | 置换反应 | 氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
9.对于下列常见化学原理的认识错误 的是( )
| A. | 明矾可用作净水剂 | |
| B. | 酒精可用于杀菌、消毒 | |
| C. | 碳酸钙是陶瓷文物的主要成分 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
10. 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为离子键、共价键.
(2)已知:①E-E→2E•;△H=+a kJ•mol-1
②2A•→A-A;△H=-b kJ•mol-1
③E•+A•→A-E;△H=-c kJ•mol-1(“•”表示形成共价键所提供的电子)写出298K时,A2与E2反应的热化学方程式(用化学式表示)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1.
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g);△H=-d kJ•mol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则该时间段内A2的平均反应速率v(A2)=0.125mol/(L.min).
②该温度下此反应的平衡常数K的值为4.
③三个容器中的反应分别达平衡时各组数据关系正确的是ADE(填序号).
A.α1+α2=1 B.α3<α1 C. n2<n3<1.0mol
D.P3<2P1=2P2 E. Q1+Q2=d F.Q3=2Q1
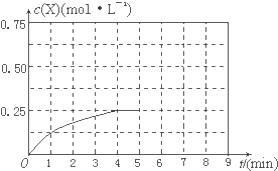
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在图中画出第5min 到新平衡时X的物质的量浓度的变化曲线.
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.(1)A、C、D形成的化合物中含有的化学键类型为离子键、共价键.
(2)已知:①E-E→2E•;△H=+a kJ•mol-1
②2A•→A-A;△H=-b kJ•mol-1
③E•+A•→A-E;△H=-c kJ•mol-1(“•”表示形成共价键所提供的电子)写出298K时,A2与E2反应的热化学方程式(用化学式表示)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1.
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g);△H=-d kJ•mol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
②该温度下此反应的平衡常数K的值为4.
③三个容器中的反应分别达平衡时各组数据关系正确的是ADE(填序号).
A.α1+α2=1 B.α3<α1 C. n2<n3<1.0mol
D.P3<2P1=2P2 E. Q1+Q2=d F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在图中画出第5min 到新平衡时X的物质的量浓度的变化曲线.
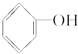 +2H2SO4(浓)$\stackrel{△}{→}$
+2H2SO4(浓)$\stackrel{△}{→}$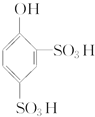
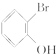 (无机试剂任选).
(无机试剂任选).