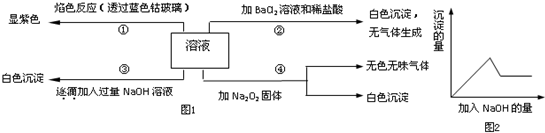
题目内容
2.写出下列各有机物的分子式或结构简式.(1)烃的含氧衍生物A分子比例模型为
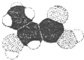 ,则A的结构简式为
,则A的结构简式为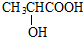 .
.(2)类比CaC2制C2H2的反应,Al4C3与水反应也能生成有机物B,则B的结构简式为CH4
(3)已知某有机物C的相对分子质量为72,试回答下列问题:
①若C只含碳、氢两元素,则其分子式为C5H12.
②若C中只有一种官能团,有两个甲基且能发生银镜反应,则其结构简式为(CH3)2CHCHO.
③若C中有一个羧基,写出该有机物与甲醇发生酯化反应生成物的结构简式CH2=CHCOOCH3.
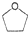
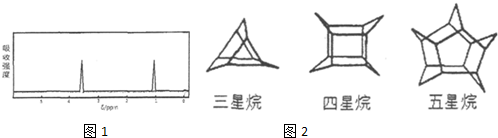
④若C在氧气中完全燃烧后,只生成等物质的量的CO2和H2O,C的核磁共振氢谱示意图如图1下时,其结构简式为
(4)如图2系列有机物中第n个分子的分子式为C(3n+6)H(4n+8)(n≥1).
分析 (1)由有机物的比例模型,可知A为 ;
;
(2)Al4C3中碳元素为-4价,与水反应生成氢氧化铝与甲烷;
(3)已知某有机物C的相对分子质量为72,
①若C只含碳、氢两元素,则$\frac{72}{14}$=5…2,故为含有5个碳原子的烷烃;
②若C中只有一种官能团,有两个甲基且能发生银镜反应,取代2个甲基、1个-CHO剩余总相对原子质量为72-29-15×2=13,为含有1个C原子、1个H原子;
③若C中有一个羧基,去掉1个羧基后剩余总相对原子质量为72-45=27,剩余基团为-CH=CH2,则C为CH2=CHCOOH;
④若C在氧气中完全燃烧后,只生成等物质的量的CO2和H2O,则C中C、H原子数目之比为1:2,令有机物为(CH2)xOy,故14x+16y=72,讨论可得x=4、y=1,故C为C4H8O,C的核磁共振氢谱有2个吸收峰,且面积之比为1:1,则两种H原子数目相等,应含有环状结构;
(4)由结构可知,第n个分子含有2(n+2)个CH原子团、(n+2)个CH2原子团.
解答 解:(1)由有机物的比例模型,可知A为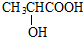 ,故答案为:
,故答案为: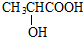 ;
;
(2)Al4C3中碳元素为-4价,与水反应生成氢氧化铝与甲烷,B的结构式为CH4,故答案为:CH4;
(3)已知某有机物C的相对分子质量为72,
①若C只含碳、氢两元素,则$\frac{72}{14}$=5…2,为含有5个碳原子的烷烃,其分子式为:C5H12,故答案为:C5H12;
②若C中只有一种官能团,有两个甲基且能发生银镜反应,取代2个甲基、1个-CHO剩余总相对原子质量为72-29-15×2=13,为含有1个C原子、1个H原子,其结构简式为(CH3)2CHCHO,故答案为:(CH3)2CHCHO;
③若C中有一个羧基,去掉1个羧基后剩余总相对原子质量为72-45=27,剩余基团为-CH=CH2,则C为CH2=CHCOOH,该有机物与甲醇发生酯化反应生成CH2=CHCOOCH3,故答案为:CH2=CHCOOCH3;
④若C在氧气中完全燃烧后,只生成等物质的量的CO2和H2O,则C中C、H原子数目之比为1:2,令有机物为(CH2)xOy,故14x+16y=72,讨论可得x=4、y=1,故C为C4H8O,C的核磁共振氢谱有2个吸收峰,且面积之比为1:1,则两种H原子数目相等,应含有环状结构,结构简式为: ,故答案为:
,故答案为: ;
;
(4)由结构可知,第n个分子含有2(n+2)个CH原子团、(n+2)个CH2原子团,含有碳原子数目为(3n+6),含有氢原子数目为(4n+8),故分子式为C(3n+6)H(4n+8)(n≥1),故答案为:C(3n+6)H(4n+8)(n≥1).
点评 本题考查有机物分子式确定与结构,侧重考查学生分析推理能力,注意残余法确定有机物分子式的方法.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 苯酚钠溶液中通入过量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | 溴乙烷的消去反应:C2H5Br+OH-$→_{△}^{水}$C2H4↑+Br-+H2O | |
| C. | 乙醇催化氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O?CH3COOH+C2H5OH |
| A. | SO3 | B. | FeCl2 | C. | Na2O2 | D. | NH3 |
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:SiO2>NaCl>CH4 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)△H<0
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)△H<0 .
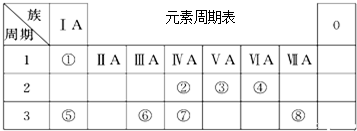
.
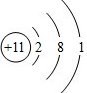 .?③元素形成的单质的电子式为:
.?③元素形成的单质的电子式为: .
. .
.