题目内容
18.下列判断正确的是( )| A. | 原子半径:Cl>P | B. | 氢化物的稳定性:CH4<SiH4 | ||
| C. | 金属性强弱:Na>Li | D. | 酸性:H2CO3>H3PO4 |
分析 A.同一周期中,原子序数越大,原子半径越小;
B.非金属性越强,对应氢化物的稳定性越强;
C.同一主族中,原子序数越大,金属性越强;
D.根据磷酸能够与碳酸钠反应生成二氧化碳气体和水分析.
解答 解:A.Cl、P位于同一周期,原子序数Cl>P,则原子半径:Cl<P,故A错误;
B.同一主族中,原子序数越大,非金属性越强,则非金属性C>Si,氢化物的稳定性:CH4>SiH4,故B错误;
C.Na、Li位于同一主族,原子序数越大,金属性越强,原子序数Na>Li,则金属性:Na>Li,故C正确;
D.磷酸能够与碳酸钠反应转化成碳酸,说明酸性:H2CO3<H3PO4,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律内容为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
8.对于可逆反应:2SO2+O2?2SO3,在某密闭容器中达到化学平衡状态后,再往此容器中通入18O2,较长时间后,下列有关说法中正确的是( )
| A. | 18O原子只存在氧气中 | |
| B. | 18O原子只存在三氧化硫中 | |
| C. | 18O一定不存在二氧化硫中 | |
| D. | 氧气中,二氧化硫中,三氧化硫中都可能存在18O |
10.在托盘天平的两个托盘上放两个质量相同的烧杯,并在烧杯中分别加入100mL 1mol•L-1硫酸.现在在天平右盘的烧杯里放入0.1mol锌,为了保持天平平衡,则应在天平左盘的烧杯里放入铁( )
| A. | 0.1mol | B. | 0.01mol | C. | 6.5g | D. | 5.6g |
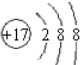 ;
;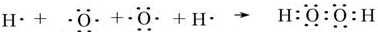 ;
;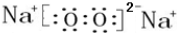 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,lmolH发生该反应转移电子数为6.02×1023或NA;
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,lmolH发生该反应转移电子数为6.02×1023或NA;

 DBrCH2CH2Br
DBrCH2CH2Br .
.