题目内容
10.在托盘天平的两个托盘上放两个质量相同的烧杯,并在烧杯中分别加入100mL 1mol•L-1硫酸.现在在天平右盘的烧杯里放入0.1mol锌,为了保持天平平衡,则应在天平左盘的烧杯里放入铁( )| A. | 0.1mol | B. | 0.01mol | C. | 6.5g | D. | 5.6g |
分析 在托盘天平的两个托盘上放两个质量相同的烧杯,并在烧杯中分别加入100mL 1mol•L-1硫酸即0.1mol.现在在天平右盘的烧杯里放入0.1mol锌,则锌和硫酸能恰好完全反应生成0.1mol氢气,故右盘增重的质量为6.5g-0.2g=6.3g.若在左盘加入铁,由于铁的摩尔质量小于锌,为56g/mol,故若想增重6.3g,则加入的铁的物质的量应大于0.1mol,据此分析计算.
解答 解:在托盘天平的两个托盘上放两个质量相同的烧杯,并在烧杯中分别加入100mL 1mol•L-1硫酸即0.1mol.现在在天平右盘的烧杯里放入0.1mol锌,则锌和硫酸能恰好完全反应生成0.1mol氢气,故右盘增重的质量为6.5g-0.2g=6.3g.为了保持天平平衡,则左盘也应增重6.3g.若在左盘加入铁,由于铁的摩尔质量小于锌,为56g/mol,故若想增重6.3g,则加入的铁的物质的量应大于0.1mol.
设左盘加入铁的物质的量为xmol,则一定有x>0.1mol,故铁0.1mol硫酸反应时,铁过量,生成氢气的量由硫酸决定,故为0.1mol,故左盘增重的质量为:
56g/mol×xmol-0.1mol×2g/mol=6.3g
解得x=$\frac{6.5g}{56g/mol}$=$\frac{6.5}{56}$mol
质量m=$\frac{6.5}{56}mol×56g/mol$=6.5g,故选C.
点评 本题考查了金属和酸反应后溶液的增重问题,应首先判断出铁的物质的量需大于锌的物质的量,然后根据当一种物质过量时,应根据量少的物质来计算产物的量来分析.

练习册系列答案
相关题目
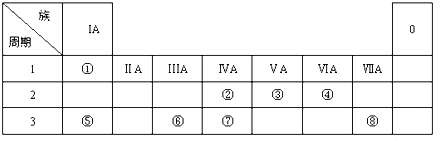
1. 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
(1)Y在周期表中的位置是第二周期第VIA族.
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是SiO2+4HF═SiF4+2H2O.
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲的电子式是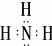 ,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
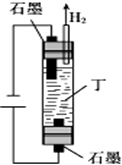
(6)工业上用如图所示装置电 解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂.该反应的离子方程式是Cl-+H2O═ClO-+H2↑.
 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是SiO2+4HF═SiF4+2H2O.
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲的电子式是
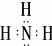 ,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.(6)工业上用如图所示装置电 解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂.该反应的离子方程式是Cl-+H2O═ClO-+H2↑.
18.下列判断正确的是( )
| A. | 原子半径:Cl>P | B. | 氢化物的稳定性:CH4<SiH4 | ||
| C. | 金属性强弱:Na>Li | D. | 酸性:H2CO3>H3PO4 |
5.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 元素W位于第三周期第ⅤA族 | |
| B. | 元素Y的氢化物水溶液呈酸性 | |
| C. | 元素X、Z的各种氯化物分子中,各原子均满足8电子稳定结构 | |
| D. | 元素X与氢元素形成的原子个数比为1:1的化合物有多种 |
1.已知H-H、H-O和O═O键的键能分别为436kJ•mol-1,463kJ•mol-1,495kJ•mol-1,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=485 kJ•mol-1 | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=485 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ•mol-1 |
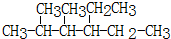 2,3-二甲基-3-乙基己烷
2,3-二甲基-3-乙基己烷 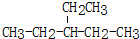 2-乙基戊烷
2-乙基戊烷