题目内容
11.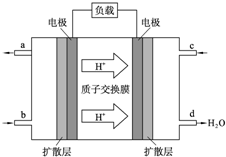 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.(1)该电池工作时,b口通入的物质为CH3OH,c口通入的物质为O2.
(2)该电池负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
(3)工作一段时间后,当6.4g甲醇完全反应生成CO2时,有1.2NA个电子转移.
分析 (1)根据装置可以知道d出生成大量的水,所以e口是通入的氧气,故b口通入的是CH3OH;
(2)乙醇发生氧化反应,在负极放电,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e-+12H+=6H2O,两式相减可得负极的电极反应式,注意电子相等;
(3)根据n=$\frac{m}{M}$计算甲醇的物质的量,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,据此计算注意电子数目.
解答 解:(1)根据装置可以知道d出生成大量的水,所以e口是通入的氧气,故b口通入的是CH3OH,故答案为:CH3OH;O2;
(2)乙醇发生氧化反应,在负极放电,总反应式为2CH3OH+3O2=2CO2+4H2O,正极电极反应为:3O2+12e-+12H+=6H2O,两式相减可得负极的电极反应式为2CH3OH-12e-+2H2O=2CO2+12H+,即CH3OH-6e-+H2O=CO2+6H+.
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(3)甲醇的物质的量为$\frac{6.4g}{32g/mol}$=0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当6.4g甲醇完全反应生成CO2时,转移电子是$\frac{0.2mol}{2mol}$×12mol=1.2mol,转移电子数目是1.2NA,故答案为:1.2.
点评 题考查原电池原理的应用等,难度不大,电极反应式的书写是易错点、难点,注意利用总反应式减去正极反应式可得负极电极反应式.

练习册系列答案
相关题目
1.下列实验能获得成功的是( )
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与溴水反应制取溴苯 | |
| C. | 向少量苯酚稀溶液中逐滴加入饱和溴水,边加边振荡,观察沉淀 | |
| D. | 1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 |
2.下列反应属于吸热反应的是( )
| A. | 金属钠与水反应 | B. | 化石燃料的燃烧 | ||
| C. | 氢氧化钡晶体与氯化铵晶体混合 | D. | 氢氧化钠与盐酸反应 |
19.下列说法正确的是( )
| A. | 甲烷分子中的两个氢原子被两个氯原子取代后,可以形成两种不同结构的有机物 | |
| B. | 乙烯完全燃烧生成CO2和H2O的物质的量之比为1:2 | |
| C. | 苯中碳碳键的键长均相等,证明苯中不存在单双键交替的结构 | |
| D. | 金属钠与乙醇反应时,金属钠在乙醇表面四处游动 |
16.含有单官能团分子式为C5H10O2且不能与饱和NaHCO3溶液反应的有机物有(不含立体异构)( )
| A. | 6种 | B. | 7种 | C. | 9种 | D. | 9种以上 |
3.下列热化学方程式书写正确的是( )
| A. | 2SO2+O2$\frac{\underline{\;500℃\;}}{V_{2}O_{5}}$2SO3△H=-196.6KJ•mol-1 | |
| B. | C(s)+O2(g)═CO2 (g)△H=+393.5KJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571kJ | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ•mol-1 |
20.下列说法正确的是( )
| A. | 流水、风力是一次能源、电力、蒸汽是二次能源 | |
| B. | 普通锌锰电池是一次性电池,碱性锌锰电池是二次电池 | |
| C. | 铅蓄电池是一次性电池,锂离子电池是二次电池 | |
| D. | 燃料电池的能量转化率可达100% |
1.在一定体积等物质的量浓度的硫酸钾溶液、明矾溶液、硫酸铁溶液中分别加入等体积等物质的量浓度的氯化钡溶液,都能恰好完全反应,则硫酸钾溶液、明矾溶液、硫酸铁溶液的体积比为( )
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:1:1 |