题目内容
1.在一定体积等物质的量浓度的硫酸钾溶液、明矾溶液、硫酸铁溶液中分别加入等体积等物质的量浓度的氯化钡溶液,都能恰好完全反应,则硫酸钾溶液、明矾溶液、硫酸铁溶液的体积比为( )| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:1:1 |
分析 根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使一定体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种溶液中硫酸根物质的量与钡离子物质的量相等,由硫酸根离子的物质的量确定硫酸盐的物质的量,浓度相同的溶液,溶质的物质的量之比等于盐溶液的体积之比.
解答 解:相同的Ba2+恰好可使一定体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,Ba2++SO42-=BaSO4↓,
则三种溶液中硫酸根物质的量与钡离子物质的量相等,设为1mol,
SO42-~K2SO4~$\frac{1}{2}$KAl(SO4)2~$\frac{1}{3}$Fe2(SO4)3,
物质的量(mol):1 1 $\frac{1}{2}$ $\frac{1}{3}$
则三种盐的物质的量这之比为:1:$\frac{1}{2}$:$\frac{1}{3}$=6:3:2,由于这三种盐的物质的量浓度相等,所以体积之比等于它们物质的量之比,即6:3:2,
故选:A.
点评 本题考查三种硫酸盐溶液的体积比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.

练习册系列答案
相关题目
12.下列有关化学用语正确的是( )
①乙烯的最简式C2H4
②乙醇的结构简式C2H6O
③四氯化碳的电子式
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3
⑥乙醛的结构简式CH3COH.
①乙烯的最简式C2H4
②乙醇的结构简式C2H6O
③四氯化碳的电子式

④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3
⑥乙醛的结构简式CH3COH.
| A. | 全对 | B. | 全错 | C. | ③⑤ | D. | ②③④ |
9.果糖的结构简式为CH2OH(CHOH)3COCH2OH,果糖中所含的手性碳原子数为( )
| A. | 0个 | B. | 2个 | C. | 3个 | D. | 4个 |
6.下列对化学反应速率和反应限度的叙述正确的是( )
| A. | 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| C. | 可逆反应进行到一定程度时,正、逆反应速率相等.各物质浓度也相等 | |
| D. | 生产过程中,化学反应限度是决定原料利用率和产品产率的重要因素之一 |
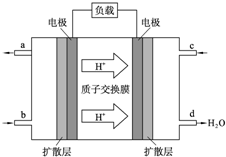 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
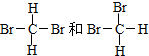 (在横线上填相应的序号)
(在横线上填相应的序号)