题目内容
19.将某元素形成的单质0.1mol与氯气充分反应,生成物的质量比原单质的质量增加了7.1g,这种元素可能是( )| A. | Na | B. | Fe | C. | Cu | D. | Al |
分析 0.1mol单质与足量氯气反应后质量增加7.1g,则参加反应氯气的质量为7.1g,其物质的量为$\frac{7.1g}{71g/mol}$=0.1mol,根据电子转移守恒计算金属在反应中的化合价,以此来解答.
解答 解:0.1mol单质与足量氯气反应后质量增加7.1g,则参加反应氯气的质量为7.1g,其物质的量为$\frac{7.1g}{71g/mol}$=0.1mol,根据电子转移守恒,可知金属在反应中的化合价为$\frac{0.1mol×2}{0.1}$=+2价,Na与氯气反应表现+1价,Al、Fe与氯气反应表现+3价,Cu与氯气表现+2,
故选C.
点评 本题考查化学方程式的有关计算,难度不大,判断7.1g为参加反应的氯气的质量是关键,可以根据金属与氯气按1:1反应判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是( )
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量 | |
| C. | 牛奶久置变质腐败 | |
| D. | 氧化铜固体加入稀盐酸中,完全溶解 |
10.下列情况会对人体健康造成较大危害的是( )
| A. | 用SO2漂白食品 | |
| B. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| C. | 自来水中通入少量Cl2进行消毒杀菌 | |
| D. | 用小苏打(NaHCO3)发酵面团制作馒头 |
7.下列关于Fe(OH)3胶体的说法中正确的是( )
| A. | Fe(OH)3胶体外观不均匀 | |
| B. | 取几滴Fe(OH)3胶体于双层滤纸上,下层滤纸呈无色 | |
| C. | 对Fe(OH)3胶体的研究有助于纳米科技的发展 | |
| D. | Fe(OH)3胶体不稳定,静置后容易产生沉淀 |
14.反应4A(s)+3B(g)═2C(g)+D(g),经过2min,B的浓度减少0.6mol/L,对此反应速率的表示正确的是( )
| A. | 在这2 min内A浓度减少了0.8 mol/L | |
| B. | 分别用B、C、D表示的反应速率的比值为3:2:1 | |
| C. | 在2 min末的反应速率,用B表示是:0.3 mol/(L•min) | |
| D. | 在这2 min内用D表示的化学反应速率为:0.2mol/(L•min) |
11.标况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)( )
| A. | 此反应中水既不是氧化剂又不是还原剂 | |
| B. | 试管内溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 溶液体积占试管容积的三分之二 | |
| D. | 若将试管中的气体换为氯化氢或者氨气,则水充满试管 |
8.实验室保存下列物质的方法中,不正确的是( )
| A. | 将NaOH溶液存放于磨口玻璃塞的试剂瓶 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
4.下列实验操作正确的是( )
| A. | 分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液小火加热蒸干 | |
| C. | 利用蒸馏的方法进行乙醇与水的分离时,温度计水银球应放在液面以下来准确测定温度 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
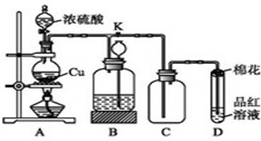 某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验. 甲同学取ag Cu 片和12ml 18mol/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余.
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验. 甲同学取ag Cu 片和12ml 18mol/L浓H2SO4放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余.