题目内容
常温下,将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系是 ,而常温下,1mol?L-1的CH3COOH溶液与1mol?L-1的NaOH溶液等体积混合后,所得溶液中离子浓度关系是 .
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:
分析:常温下,HCl是强电解质、NH3.H2O是弱电解质,所以pH=3的盐酸为0.001mol/L,pH=11的氨水浓度大于0.001mol/L,二者等体积混合,氨水有剩余,NH3.H2O电离程度大于NH4+水解程度,所以溶液呈碱性,再结合电荷守恒判断c(Cl-)、c(NH4+)相对大小;
CH3COOH是弱电解质、NaOH是强电解质,物质的量浓度、体积相等的CH3COOH和NaOH溶液混合,二者恰好反应生成CH3COONa,CH3COONa是强碱弱酸盐,CH3COO-水解导致溶液呈碱性,再结合电荷守恒判断c(CH3COO-)、c(Na+)相对大小.
CH3COOH是弱电解质、NaOH是强电解质,物质的量浓度、体积相等的CH3COOH和NaOH溶液混合,二者恰好反应生成CH3COONa,CH3COONa是强碱弱酸盐,CH3COO-水解导致溶液呈碱性,再结合电荷守恒判断c(CH3COO-)、c(Na+)相对大小.
解答:
解:常温下,HCl是强电解质、NH3.H2O是弱电解质,所以pH=3的盐酸为0.001mol/L,pH=11的氨水浓度大于0.001mol/L,二者等体积混合,氨水有剩余,NH3.H2O电离程度大于NH4+水解程度,所以溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(Cl-)<c(NH4+),溶液中一水合氨电离程度较小,所以溶液中离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+);
CH3COOH是弱电解质、NaOH是强电解质,物质的量浓度、体积相等的CH3COOH和NaOH溶液混合,二者恰好反应生成CH3COONa,CH3COONa是强碱弱酸盐,CH3COO-水解导致溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(CH3COO-)<c(Na+),盐类水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
CH3COOH是弱电解质、NaOH是强电解质,物质的量浓度、体积相等的CH3COOH和NaOH溶液混合,二者恰好反应生成CH3COONa,CH3COONa是强碱弱酸盐,CH3COO-水解导致溶液呈碱性,则c(OH-)>c(H+),再结合电荷守恒得c(CH3COO-)<c(Na+),盐类水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
点评:本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,侧重考查分析能力,注意区别二者呈碱性原因,熟练运用守恒思想解答问题,题目难度中等.

练习册系列答案
相关题目
下列物质中,属于纯净物的是( )
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
| A、③⑦ | B、③④⑥ | C、⑤⑦ | D、⑥⑦ |
常温下,对于0.10mol?L-1的氯水,下列判断不正确的是( )
| A、与NaClO溶液混合后,溶液中c(OH-)/c(H+)变大 |
| B、加入CaCO3粉末后,溶液中c(HClO)变大 |
| C、久置后,溶液中离子种类减少 |
| D、该溶液的pH=1 |
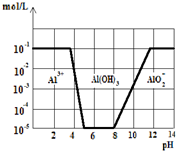 常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标
常温下,在0.1mol?L-1KAl(SO4)2溶液中,加入KOH固体,如图,横坐标为溶液的pH,纵坐标为Al3+离子或AlO2-离子的物质的量浓度.(假设Al3+
离子浓度为10-5mol?L-1时,Al3+离子已沉淀完全),下列说法不正确的是( )
| A、从图中数据计算可得Al(OH)3的溶度积Ksp=10-23 |
| B、沉淀Al3+可以控制溶液pH的范围为5~8 |
| C、向KAl(SO4)2溶液中加入KOH固体至pH=7时,c(K+):c(SO42-)=2:1 |
| D、往KAl(SO4)2溶液中加入足量的氢氧化钾溶液,反应的离子方程式可表示为:Al3++4OH-=AlO2-+2H2O |
下列叙述正确的是( )
| A、钢管与电源正极连接,可对钢管进行电化学保护 |
| B、利用高压氧舱治疗煤气中毒是依据平衡移动原理 |
| C、配制氯化亚锡(SnCl2)溶液时需加适量盐酸防止被氧化变浑浊 |
| D、用Fe除去溶液中的Cu2+、Hg2+与用FeS除去溶液中的Cu2+、Hg2+的原理相同 |
下列有机物的系统名称中,正确的是( )
| A、2,4,4-三甲基戊烷 |
| B、4-甲基-2-戊烯 |
| C、3-甲基-5-异丙基庚烷 |
| D、1,2,4-三甲基丁烷 |
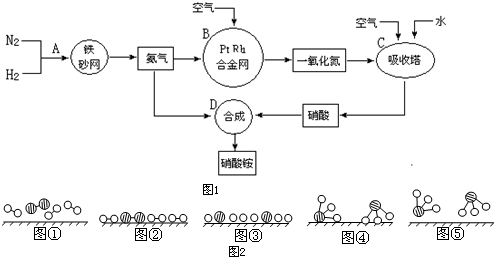
 分别表示N2、H2、NH3.
分别表示N2、H2、NH3.
 纯净物根据其组成和性质可进行如图所示分类
纯净物根据其组成和性质可进行如图所示分类