题目内容
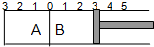 如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),
如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),填空:
(1)固定活塞位置在3处不动,达到平衡后,设A中压强为P1,B中压强为P2,则P1与P2的大小是:P1
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x
考点:化学平衡的计算
专题:
分析:根据左右两个容器压强相等,从等效平衡的角度分析;
(1)充入的氮气相当于增大体系压强,平衡不动;
(2)根据左右两个容器压强相等,从等效平衡的角度分析;
(3)若使A与B中平衡状态相同且达平衡时活塞在4.5处,则B中必须相当于3 mol SO2和1.5 mol O2,故应再通入SO3 1 mol.若活塞右移到5处,则B中压强减小平衡向生成SO2的方向移动.
(1)充入的氮气相当于增大体系压强,平衡不动;
(2)根据左右两个容器压强相等,从等效平衡的角度分析;
(3)若使A与B中平衡状态相同且达平衡时活塞在4.5处,则B中必须相当于3 mol SO2和1.5 mol O2,故应再通入SO3 1 mol.若活塞右移到5处,则B中压强减小平衡向生成SO2的方向移动.
解答:
解:(1)A中充入2 mol SO2和1mol O2与B中充入2 mol SO3和1mol N2,由于N2与反应无关,故只占分压,
活塞在3处时相同条件下达平衡时是等效的,但B中有1mol N2,故压强比A大,P1<P2,
故答案为:<;
(2)A中充入2mol SO2和1mol O2与B中充入2mol SO3和1mol N2,由于N2与反应无关,故只占分压,活塞在3处时相同条件下达平衡时是等效的,所以若使A与B中平衡状态相同,将活塞固定在“3”处,
故答案为:3;
(3)在3处AB时两个平衡状态相同,若活塞右移到5处,则B中压强减小平衡向生成SO2的方向移动,故n(SO3)减小,x<y,
故答案为:<;活塞在3处时,A和B平衡状态相同,若活塞右移到5处,则B中压强减小,平衡向生成SO2的方向移动,故n(SO3)减小,x<y.
活塞在3处时相同条件下达平衡时是等效的,但B中有1mol N2,故压强比A大,P1<P2,
故答案为:<;
(2)A中充入2mol SO2和1mol O2与B中充入2mol SO3和1mol N2,由于N2与反应无关,故只占分压,活塞在3处时相同条件下达平衡时是等效的,所以若使A与B中平衡状态相同,将活塞固定在“3”处,
故答案为:3;
(3)在3处AB时两个平衡状态相同,若活塞右移到5处,则B中压强减小平衡向生成SO2的方向移动,故n(SO3)减小,x<y,
故答案为:<;活塞在3处时,A和B平衡状态相同,若活塞右移到5处,则B中压强减小,平衡向生成SO2的方向移动,故n(SO3)减小,x<y.
点评:本题考查了化学平衡的计算,主要考查等效平衡及其判断的知识,题目难度中等,明确等效平衡的含义、正确判断等效平衡为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
下列除杂(括号内是杂质),所用方法合理的是( )
| A、碳酸氢钠固体(碳酸钠):加热固体混合物使之分解 |
| B、铁粉(铝):加入足量稀盐酸,充分反应后过滤、洗涤、干燥 |
| C、硫酸亚铁溶液(硫酸铁):加入足量铁屑,充分反应后过滤 |
| D、二氧化碳(氯化氢):依次通过盛有氢氧化钠溶液、浓硫酸的洗气瓶 |
实验是化学研究的基础.下列实验能达到实验目的是( )
A、 石油的分馏 |
B、 分离硝基苯和水 |
C、 除去甲烷中的乙烯 |
D、 制取并收集乙炔气体 |
不另用任何试剂就能将下列四种溶液:①CuCl2、②NH4Cl、③KCl、④NaOH、鉴别出来,其正确的鉴别顺序是( )
| A、①②④③ | B、④③②① |
| C、①④②③ | D、①②③④ |
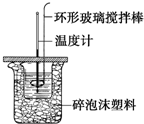 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下: