题目内容
16.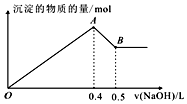 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 6:1 |
分析 依据图中关系可知,加入氢氧化钠溶液0.4体积时,发生反应AlCl3~Al(OH)3↓、MgSO4~Mg(OH)2↓,则0.4V~0.5体积时NaOH发生了NaOH与氢氧化铝的反应,由铝原子守恒可判断原溶液中的铝离子,即得出氯离子的量,依据0~0.4V氢氧化钠溶液时发生反应AlCl3~Al(OH)3↓、MgSO4~Mg(OH)2↓,求出Mg2+的量,进而得到SO42-的物质的量,据此解答.
解答 解:第一条上升的直线是表示AlCl3和MgSO4一起产生沉淀,第二条下降的直线表示Al(OH)3沉淀溶解,设氢氧化钠溶液的浓度为c,根据Al(OH)3+OH-═AlO2-+2H2O,第二条直线可知加入0.1V体积的NaOH将氢氧化铝完全溶解,可知AlCl3是0.1cVmol,则氯离子的物质的量为0.3cVmol,再根据Al3++3OH-═Al(OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠0.3V体积;
再根据第一条直线可知,0.4V-0.3V=0.1V体积的氢氧化钠将镁离子全部沉淀,而Mg2++2OH-═Mg(OH)2↓,所以MgSO4为0.05cVmol,所以硫酸根离子的物质的量为0.05cVmol,
所以原溶液中Cl-与SO42-的物质的量之比为0.3cVmol:0.05cVmol=6:1,
故选:D.
点评 本题考查了有关离子方程式的计算,明确图中各段发生的离子反应是解题关键,注意氢氧化铝的两性,题目难度中等.

练习册系列答案
相关题目
6.下列实验操作正确的是( )
| A. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶 |
7.下列有关物质变化和分类的说法正确的是( )
| A. | 电解熔融态的Al2O3、12C转化为14C都属于化学变化 | |
| B. | 胆矾、冰水混合物、四氧化三铁都是纯净物 | |
| C. | 根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸 | |
| D. | SiO2、NO2、Al2O3都属于酸性氧化物 |
4.常温下,下列各组离子或分子在指定分散系中一定能大量共存的是( )
| A. | pH=l的溶液中:Na+、I-、NO3-、SO42- | |
| B. | 氢氧化铁胶体中:H+、K+、Cl-、S2- | |
| C. | 在pH=0的溶液中:Na+、NH4+、CH3COOH、Cl- | |
| D. | 水电离产生的c(H+)=1×10-12mol•L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
11. 恒温恒容装置中发生如下反应:A(g)+2B(g)?2C(g)△H=-a kJ•mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如图所示.下列说法正确是( )
恒温恒容装置中发生如下反应:A(g)+2B(g)?2C(g)△H=-a kJ•mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如图所示.下列说法正确是( )
 恒温恒容装置中发生如下反应:A(g)+2B(g)?2C(g)△H=-a kJ•mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如图所示.下列说法正确是( )
恒温恒容装置中发生如下反应:A(g)+2B(g)?2C(g)△H=-a kJ•mol-1(a>0),开始时充入一定量的A和B,B的反应速率随时间变化如图所示.下列说法正确是( )| A. | 反应放出的热量一定小于a kJ | |
| B. | 5s后,反应停止,各物质浓度保持不变 | |
| C. | 5s末,ν(A):ν(B)=1:2 | |
| D. | 阴影部分面积可以表示A的物质的量浓度减少量 |
1.在标准状况下,将28L HCl气体溶液在水中配成250mL盐酸溶液
(1)求所得盐酸的物质的量浓度5mol/L
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度0.25mol/L.
(1)求所得盐酸的物质的量浓度5mol/L
(2)若取此溶液50mL再稀释成1L溶液,求稀释后盐酸的物质的量浓度0.25mol/L.
8.下列关于卤素(用X表示)的叙述中正确的是( )
| A. | 卤素单质与水反应的通式为X2+H2O═HX+HXO | |
| B. | HX都极易溶于水,它们的稳定性随核电荷数的增加而增强 | |
| C. | 卤素单质的颜色随相对分子质量的增大而加深 | |
| D. | X2的氧化性随核电荷数的增加而增强 |
5.下列说法正确的是( )
| A. | c(H+)=$\sqrt{{K}_{W}}$的溶液一定呈中性 | |
| B. | 金属钠、镁着火时可用泡沫灭火器扑灭 | |
| C. | 用玻璃棒蘸取待测液于湿润的pH试纸上测pH 值 | |
| D. | 常温下1L PH=13的Ba(OH)2溶液中含有0.2NA个OH- 离子 |
6.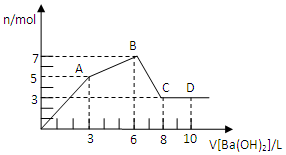 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是[Al(OH)4]- | |
| B. | 向D点溶液中通入过量CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++8OH-═2Al(OH)4-+3BaSO4↓ |