题目内容
 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:㈠制取氧化铜
①往盛有一定量CuCl2溶液的烧杯中逐滴加入NaOH溶液,直至不再产生沉淀,然后将烧杯中的物质转移到蒸发皿中,加热至沉淀全部变为黑色.
②将步骤①所得的黑色沉淀过滤、洗涤,晾干后研细备用.
(1)在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀,试分析其原因
(2)写出检验步骤②中沉淀是否洗涤干净的操作
㈡为证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,用如图装置进行实验,每次实验时均收集25ml气体,其他可能影响实验的因素均已忽略,实验数据见下表:
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ③ | 1.2g | 无其他物质 | a |
| ④ | 1.2g | CuO 0.5g | b |
| ⑤ | 1.2g | MnO2 0.5g | c |
(4)上述实验中的“待测数据”是指
(5)图中量气装置B由干燥管、乳胶管和50ml滴定管改造后组装面成,此处用滴定管是
(6)若实验证明氧化铜加快氯酸钾的分解效果比用二氧化锰差,请结合上表的实验效果数据,在坐标图中分别画出使用CuO、MnO2作催化剂时产生氧气的体积(V(O2))随时间(t)变化的曲线(注明必要的标识).
考点:性质实验方案的设计
专题:实验题
分析:(1)若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,最后也能得到黑色沉淀是加热过程中得到氢氧化铜分解生成黑色氧化铜;
(2)依据检验最后一次洗涤液中是否有氯离子设计步骤检验;
(3)氯酸钾分解反应生成氯化钾和氧气,氯元素化合价+5价变化为-1价,氧元素化合价变化为0价,结合电子守恒标注电子转移;
(4)实验的目的是:证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,上述实验中已有数据KClO3质量和其它物质质量,要比较催化效果就是看使用氧化铜与二氧化锰哪一种产生相同体积气体时所需时间短,或在相同时间内,哪一种物质产生的气体多;
(5)碱式滴定管的构造为:橡胶管、玻璃珠.酸式滴定管的构造为连在玻璃管上的玻璃活塞;
(6)标出横坐标上的c、b、t,标出纵坐标上的V(O2)/mL、25,画出CuO的曲线,b点达到平衡状态;画出MnO2的曲线缩短反应时间,c点达到平衡状态,最后达到平衡状态不变,达到平衡状态生成气体体积都是25mL.
(2)依据检验最后一次洗涤液中是否有氯离子设计步骤检验;
(3)氯酸钾分解反应生成氯化钾和氧气,氯元素化合价+5价变化为-1价,氧元素化合价变化为0价,结合电子守恒标注电子转移;
(4)实验的目的是:证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,上述实验中已有数据KClO3质量和其它物质质量,要比较催化效果就是看使用氧化铜与二氧化锰哪一种产生相同体积气体时所需时间短,或在相同时间内,哪一种物质产生的气体多;
(5)碱式滴定管的构造为:橡胶管、玻璃珠.酸式滴定管的构造为连在玻璃管上的玻璃活塞;
(6)标出横坐标上的c、b、t,标出纵坐标上的V(O2)/mL、25,画出CuO的曲线,b点达到平衡状态;画出MnO2的曲线缩短反应时间,c点达到平衡状态,最后达到平衡状态不变,达到平衡状态生成气体体积都是25mL.
解答:
解:(1)向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,需要使用玻璃棒,转移沉淀物Cu(OH)2;加热至沉淀Cu(OH)2全部分解变为黑色CuO,在实验过程中,若未加入NaOH溶液,直接将CuCl2溶液转移到蒸发皿中加热,得到氯化铜的水解产物氢氧化铜,受热最后也能得到黑色沉淀,CuCl2溶液中存在水解平衡CuCl2+2H2O?Cu(OH)2+2HCl,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO;
故答案为:CuCl2溶液中存在水解平衡CuCl2+2H2O?Cu(OH)2+2HCl,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO;
(2)步骤①所得的黑色沉淀过滤,取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净,
故答案为:取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净;
(3)氯酸钾分解反应生成氯化钾和氧气,用双线桥表示电子转移的方向和数目的化学方程式为 ,
,
故答案为: ;
;
(4)本题③④⑤三次实验,提供的KClO3质量均为1.2g,实验④的作用为:在不加催化剂的条件下产生氧气的速度与⑤加CuO 0.5g以及和⑥加MnO2 0.5g的效果作对照.⑤⑥加等质量不同的催化剂比较催化效果.比较催化效果方法一:看产生相同体积气体哪组所需时间短,方法二相同时间内,哪一组产生的气体多.该题题干要求:实验时均以收集25mL气体为准,
故答案为:收集25mL气体所需时间;
(5)本实验装置图中用50mL滴定管改造组装成量气装置,对照酸式、碱式滴定管的构造,碱式滴定管的构造符合要求.故答案为:碱式;
(6)标出横坐标上的c、b、t,标出纵坐标上的V(O2)/mL、25,画出CuO的曲线,b点达到平衡状态;画出MnO2的曲线缩短反应时间,c点达到平衡状态,最后达到平衡状态不变;达到平衡状态生成气体体积都是25ml,得到图象为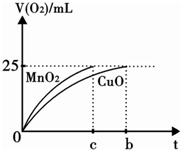 ,故答案为:
,故答案为: .
.
故答案为:CuCl2溶液中存在水解平衡CuCl2+2H2O?Cu(OH)2+2HCl,加热时HCl逸出使平衡不断右移,同时得到的Cu(OH)2受热分解生成CuO;
(2)步骤①所得的黑色沉淀过滤,取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净,
故答案为:取2~3mL最后的洗涤液于试管中,滴入少量稀硝酸酸化,再滴入几滴硝酸银溶液,若无白色沉淀产生,则洗涤干净;
(3)氯酸钾分解反应生成氯化钾和氧气,用双线桥表示电子转移的方向和数目的化学方程式为
 ,
,故答案为:
 ;
;(4)本题③④⑤三次实验,提供的KClO3质量均为1.2g,实验④的作用为:在不加催化剂的条件下产生氧气的速度与⑤加CuO 0.5g以及和⑥加MnO2 0.5g的效果作对照.⑤⑥加等质量不同的催化剂比较催化效果.比较催化效果方法一:看产生相同体积气体哪组所需时间短,方法二相同时间内,哪一组产生的气体多.该题题干要求:实验时均以收集25mL气体为准,
故答案为:收集25mL气体所需时间;
(5)本实验装置图中用50mL滴定管改造组装成量气装置,对照酸式、碱式滴定管的构造,碱式滴定管的构造符合要求.故答案为:碱式;
(6)标出横坐标上的c、b、t,标出纵坐标上的V(O2)/mL、25,画出CuO的曲线,b点达到平衡状态;画出MnO2的曲线缩短反应时间,c点达到平衡状态,最后达到平衡状态不变;达到平衡状态生成气体体积都是25ml,得到图象为
 ,故答案为:
,故答案为: .
.
点评:本题考查了物质性质的实验设计方法和步骤分析判断,综合性较强,需理清催化剂的概念、熟悉滴定管的构造、掌握铜及其化合物的性质来解答,题目难度较大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
| A、Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存 |
B、 向O.1mo1-L-1该物质的溶液中清加0.Lmol-1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示 |
| C、检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 |
| D、向该物质的溶液中摘加Ba(OH)2溶液,恰好使S042-完全沉淀的离子方程式为:Fe2++2SO42-+3Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
已知同周期的X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,下列判断正确的是( )
| A、阴离子的还原性按X、Y、Z的顺序增强 |
| B、单质的氧化性按X、Y、Z的顺序减弱 |
| C、元素的非金属性按X、Y、Z的顺序增强 |
| D、电负性按X、Y、Z的顺序减小 |
下列各物质中所含原子数目最多的是( )
| A、0.5 mol NH3 |
| B、标准状况下22.4 L He |
| C、4℃时 9 mL 水 |
| D、0.2 mol H2SO4 |

