题目内容
5.(1)5mol的CO2与8mol的SO2的分子数比是5:8;原子数比是5:8;电子数比是55:128.(2)已知 9gCO和CO2的混合气体,在标准状况下占5.6L,则CO的物质的量为0.125mol,CO2在标准状况下的体积为2.8L.
分析 (1)根据N=nNA确定其分子数之比,再结合每个分子中含有的原子个数、电子数计算其原子数比和电子数比;
(2)混合气体的物质的量为:n=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据质量之和和物质的量之和列式计算.
解答 解:(1)根据N=nNA,二者分子数之比等于物质的量之比,故二者分子数之比=5:8;每个二氧化碳和二氧化硫分子中均含有3个原子,故原子数比等于分子数之比,为5:8;每个二氧化碳分子中含有22个电子,每个二氧化硫分子中含有32个电子,故电子数之比:(5×22):(8×32)=55:128.故答案为:5:8;5:8;55:128.
(2)n(CO2)+n(CO)=$\frac{5.6L}{22.4L/mol}$=0.25mol,n(CO2)×44g/mol+n(CO)×28g/mol=9g,解得:n(CO2)=0.125 mol,n(CO)=0.125 mol,V(CO2)=0.125mol×22.4L/mol=2.8L,故答案为:0.125;2.8.
点评 本题考查学生利用质量和气体的体积进行简单计算,为高频考点,明确质量、体积、物质的量的关系即可解答,难度不大.

练习册系列答案
相关题目
1.下列关于有机物的说法正确的是( )
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| C. |  能发生加成反应和取代反应 能发生加成反应和取代反应 | |
| D. | 合成纤维与光导纤维都属于有机高分子材料 |
2.下列有关电解质溶液说法正确的是( )
| A. | HCN溶液加水稀释,电离度保持不变,$\frac{c({F}^{-})}{c(HF)}$增大 | |
| B. | 向氨水中加入NH4Cl固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大 | |
| C. | NH4HCO3溶液呈碱性,由此可知Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | AgCl在饱和NaCl溶液中的溶解度及Ksp都比在纯水中的小 |
13.下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是( )
| A. | 盐酸、硫酸铜、硫酸 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、石灰水、烧碱 |
10.某课外小组对一些金属单质和化合物的性质进行研究.
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应2Al+6H+═2Al3++3H2↑或2Al+3Cu2+═2Al3++3Cu,
化合反应2Cu+O2+H2O+CO2═Cu2(OH)2CO3.
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是有白色沉淀生成,后沉淀逐渐溶解至消失,解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是CuO对H2O2的分解有催化作用.
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:水槽(或集气瓶)、导管、量筒、秒表(计时器).
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色 |
置换反应2Al+6H+═2Al3++3H2↑或2Al+3Cu2+═2Al3++3Cu,
化合反应2Cu+O2+H2O+CO2═Cu2(OH)2CO3.
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是有白色沉淀生成,后沉淀逐渐溶解至消失,解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是CuO对H2O2的分解有催化作用.
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:水槽(或集气瓶)、导管、量筒、秒表(计时器).
17.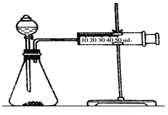 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
14.为了探究外界条件对反应速率的影响,某化学小组利用KI溶液在酸性条件下能被空气中的O2氧化来实现该目的.该反应的离子方程式为O2+4I-+4H+=212+2H2O
(1)该小组同学设计如下实验,完成下表中①和②的内容.(限选试剂:0.l mol/L硫酸、0.2mol/L硫酸、I mol/L KOH溶液、淀粉溶液).
(2)在上述实验中,三种溶液混合的顺序最合理的是C(选填下列选项);应记录的内容是溶液从无色变为蓝色所需的时间.
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应;假设二:溶液碱性弱,I2和KOH不反应; 假设三:…
请设计实验验证假设二,完成表中的内容
(限选试剂:1mol/L盐酸、1mol/L KOH溶液、碘水、淀粉溶液)
(1)该小组同学设计如下实验,完成下表中①和②的内容.(限选试剂:0.l mol/L硫酸、0.2mol/L硫酸、I mol/L KOH溶液、淀粉溶液).
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 25℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;2组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 35℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 35℃ | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应;假设二:溶液碱性弱,I2和KOH不反应; 假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/L KOH溶液,观察现象. | 若蓝色不褪色,则假设二正确. |
15.醋酸的下列性质中,可以证明它是弱电解质的是( )
| A. | 1mol/L的醋酸溶液中c(H+)=0.01 mol/L | |
| B. | 醋酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 醋酸溶液的导电性比盐酸的弱 |