题目内容
14.把a g铜、铁合金粉末投入足量盐酸中,反应完全后过滤,向滤液中加入过量氢氧化钠溶液,过滤,沉淀经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则此合金中铜的质量分数为30%.分析 铜与铁总质量为a g,与盐酸反应会生成氯化亚铁,滤液中加入过量氢氧化钠溶液反应后所得红棕色粉末为Fe2O3,Fe2O3的质量仍为a g,说明Cu的质量等于Fe2O3中O元素的质量.
解答 解:铜与铁总质量为a g,与盐酸反应会生成氯化亚铁,滤液中加入过量氢氧化钠溶液反应后所得红棕色粉末为Fe2O3,Fe2O3的质量仍为a g,说明Cu的质量等于Fe2O3中O元素的质量,则合金中Cu的质量分数等于Fe2O3中O元素的质量分数=$\frac{48}{160}$×100%=30%,
故答案为:30%.
点评 本题考查混合物有关计算,明确发生的反应找出合金中Cu与氧化物中氧元素质量关系是解答本题的关键,注意铁元素的守恒.

练习册系列答案
相关题目
4.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 12.0 g熔融的NaHSO4中含有离子总数为0.2NA | |
| B. | 电解精炼Cu时,导线中通过2NAe-时,阳极质量减少64 g | |
| C. | 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA | |
| D. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
5.要想证明某溶液中是否含有Fe3+,下列操作中正确的是( )
| A. | 加入铁粉 | B. | 通入氯气 | C. | 加入铜片 | D. | 滴加KSCN溶液 |
9.下列化学用语表达不正确的是( )
| A. | 丙烷的球棍模型为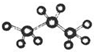 | B. | 丙烯的结构简式为CH3CHCH2 | ||
| C. | 符合通式CnH2n+2的一定是烷烃 | D. | O2、O3属于同素异形体 |
19.已知乙炔(C2H2),苯(C6H6),乙醛(C2H4O)的混合气体中氧的质量分数为8%,则混合气中氢的质量分数为( )
| A. | 8% | B. | 9% | C. | 10% | D. | 5% |
6.下列说法正确的是( )
| A. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 | |
| B. | 在BaC12溶液中通入SO2气体,溶液仍澄清,滴入3%过氧化氢溶液有白色沉淀 | |
| C. | 二氧化硫气体能用浓硫酸干燥,说明二氧化硫无还原性 | |
| D. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 |
3.下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
| A. | 甲烷与氯气混合后光照发生反应 | B. | 乙炔与氯气的加成反应 | ||
| C. | 乙烯与氯化氢的加成反应 | D. | 二氧化碳通入石灰水中 |