题目内容
4.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 12.0 g熔融的NaHSO4中含有离子总数为0.2NA | |
| B. | 电解精炼Cu时,导线中通过2NAe-时,阳极质量减少64 g | |
| C. | 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA | |
| D. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
分析 A.熔融的NaHSO4中含有的阳离子只有钠离子;
B.若阴极得到电子数为2NA个,转移的电子为2mol,由于粗铜中含有杂质铁,电解时铁优先放电,导致溶解的铜减少;
C.气体摩尔体积所以对象为气体;
D.氯气和水的反应为可逆反应.
解答 解:A.12.0g熔融的NaHSO4的物质的量为0.1mol,0.1mol熔融硫酸氢钠电离出0.1mol钠离子和0.1mol硫酸氢根离子,所以含有的离子数为0.2NA,故A正确;
B.阴极得到电子数为2NA个,转移的电子为2mol,由于粗铜中含有杂质铁,电解过程中铁优先放电,则铜失去的电子小于2mol,电解的铜的物质的量小于1mol,质量小于64g,故B错误;
C.标况下三氯甲烷为液体,不能使用气体摩尔体积,故C错误;
D.氯气和水的反应为可逆反应,不能完全反应,故转移的电子数小于0.1NA个,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的使用及有关计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件即可解答,注意硫酸氢钠熔融状态下电离与水溶液中电离方式的不同,题目难度中等.

练习册系列答案
相关题目
13.X、Y、Z、W均为短周期元素,原子序数依次递增.X与W位于同一主族,Y、Z、W同周期,Z原子的最外层电子数是最内层电子数的3倍,Y、Z、W原子的最外层电子数之和为15.下列说法正确的是( )
| A. | X的最高价氧化物对应水化物的酸性大于W | |
| B. | Z的气态氢化物的稳定性大于W | |
| C. | YZ和ZW2所含化学键类型相同 | |
| D. | 简单离子半径:r(Y2+)<r(X-)<r(W-)<r(Z2-) |
12.某有机物的结构简式为 ,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )
,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )
 ,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )
,它在一定条件下能发生的反应有①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤中和反应 ⑥消去反应( )| A. | ②③④ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ②③④⑤⑥ |
16.短周期元素X、Y、Z、Q在元素周期表中的相对位置如图,地壳中含量最高的元素已包含其中.回答下列问题:
(1)Q在元素周期表中的位置是第二周期VIA族.X离子的结构示意图为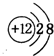 .
.
(2)下列选项中,能证明元素非金属性Z强于Y的是C.
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z-,该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4kJ/mol.
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n,在25℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH=10.3(已知:25℃,Ksp[X(OH)n]=4.0×l0-12;lg5=0.7).
| Y | Q | ||||
| X | Z |
 .
.(2)下列选项中,能证明元素非金属性Z强于Y的是C.
A.反应中,Y原子得到的电子数比Z原子得到的电子数多
B.最高正价,Z比Y的高
C.最高价氧化物的水化物酸性:Z>Y
(3)ZQ2是国际公认高效安全杀菌消毒剂,已知ZQ2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ZQ2被还原为Z-,该反应的离子方程式为5Mn2++2ClO2+6H2O=5MnO2↓+2Cl-+12H+.
(4)H元素与Y形成的化合物中二者的质量之比是1:3,已知常温下4g该化合物完全燃烧并恢复到原来温度时放出222.6kJ热量,则表示该化合物燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.4kJ/mol.
(5)表中X的最高价氧化物对应水化物的化学式为X(OH)n,在25℃时,其饱和溶液能使酚酞试液变红,则其饱和溶液中的pH=10.3(已知:25℃,Ksp[X(OH)n]=4.0×l0-12;lg5=0.7).

 ,F
,F .
.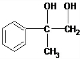 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.

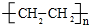 ;
;