题目内容
17.煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应方程式为:4FeS2+11O2=2Fe2O3+8SO2,为了提高SO2的生成速率,下列措施可行的( )| A. | 增加硫铁矿石的投入量 | B. | 增加炉的高度 | ||
| C. | 降低温度 | D. | 升高温度 |
分析 反应物浓度、温度、催化剂、反应物接触面积、压强(仅适用于有气体参与的反应)对化学反应速率都有影响,以此解答该题.
解答 解:反应物浓度、温度、催化剂、反应物接触面积、压强(仅适用于有气体参与的反应)对化学反应速率都有影响,要提高二氧化硫的速率,可以通过增大氧气的浓度、升高温度、增大压强来实现,而增加硫铁矿石的投入量、增加炉的高度对反应速率无影响,
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,明确反应速率影响因素适用范围是解本题关键,注意固体和纯液体没有浓度,为易错点.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
7.Ca(ClO)2是漂白粉的有效成分.用漂白粉漂白时,不能使漂白粉更好发挥漂白作用的物质是( )
| A. | 酒精 | B. | CO2和水蒸汽 | C. | 盐酸 | D. | 食醋(含CH3COOH) |
8.暴露在空气中不易变质的是( )
| A. | 钠 | B. | 氧化钙 | C. | 氯化钠 | D. | 氢氧化钠 |
12.下列关于碱金属的叙述,正确的是( )
| A. | 金属钠着火时,可用水或泡沫灭火器灭火 | |
| B. | 碱金属单质都可保存在煤油中 | |
| C. | 钠离子半径比钠原子半径小 | |
| D. | 碱金属中密度最小,熔、沸点最高的是铯 |
2.下列各组物质中,都是由极性键构成为极性分子的一组的是( )
| A. | PCl3和H2S | B. | PCl5和HCl | C. | CH4和H2O | D. | HCN和BF3 |
9.下列属于化学变化的是( )
| A. | 向饱和的硫酸铵溶液中滴加蛋清溶液 | |
| B. | 日本核电站工作人员给核电机组注水降温 | |
| C. | 炼油厂蒸馏原油获得汽油、煤油等产品 | |
| D. | 露置于空气中的镁带表面逐渐变黑 |
6.下列反应的离子方程式正确的是( )
| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| B. | NaHCO3溶液和足量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
2.下列有关高分子化合物的说法不正确的是( )
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: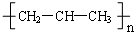 | |
| B. | 某塑料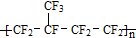 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子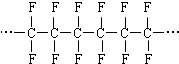 的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料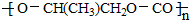 可由 可由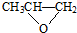 和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
