题目内容
6.下列反应的离子方程式正确的是( )| A. | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| B. | NaHCO3溶液和足量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| C. | 酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
分析 A.反应生成氢氧化铝和氯化铵;
B.反应生成碳酸钙、NaOH、水;
C.酸性条件下不能生成氢氧根离子;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.向AlCl3溶液中加入过量的浓氨水的离子反应为Al3++3NH3•H2O=A1(OH)3↓+3NH4+,故A错误;
B.NaHCO3溶液和足量Ca(OH)2溶液反应的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故B错误;
C.性条件下,KIO3溶液与KI溶液反应的离子反应为IO3-+5I-+6H+═3I2+3H2O,故C错误;
D.Fe2+与H2O2在酸性溶液中的反应的离子反应为2Fe2++H2O2+2H+═2Fe3++2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
16.某1L溶液中含有大量的Cl-、Br-、I-,若向1L该溶液中通入一定量的氯气,溶液中Cl-、Br-、I-的物质的量与通入的氯气的体积(标准状况)的量关系如表所示,分析后判断下列说法正确的是( )
| V(Cl2)(标况,L) | 2.8 | 5.6 | 11.2 |
| n(Cl-) mol | 1.5 | 1.75 | 2.25 |
| n(Br-) mol | 1.5 | 1.4 | 0.9 |
| n(I-)mol | a | 0 | 0 |
| A. | 当通入氯气的体积为2.8L时,溶液中发生的离子反应式只有:Cl2+2I-═2Cl-+I2 | |
| B. | 表中a的值为0.5 | |
| C. | 原溶液中Cl-、Br-、I-物质的量之比为15:15:8 | |
| D. | 原溶液中I-的物质的量浓度为0.25mol/L |
17.煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应方程式为:4FeS2+11O2=2Fe2O3+8SO2,为了提高SO2的生成速率,下列措施可行的( )
| A. | 增加硫铁矿石的投入量 | B. | 增加炉的高度 | ||
| C. | 降低温度 | D. | 升高温度 |
14.现有甲、乙两种易溶于水的化合物,已知甲的水溶液不导电,乙的水溶液能导电,下列有关说法正确的是( )
| A. | 甲一定是共价化合物,乙一定是离子化合物 | |
| B. | 甲一定是共价化合物,乙可能是共价化合物 | |
| C. | 甲可能是离子化合物,乙可能是共价化合物 | |
| D. | 甲一定是离子化合物,乙可能是共价化合物 |
10.C、Cl、S、Ti、Fe、Cr元素的单质和化合物的应用研究是目前科学研究的前沿之一,请回答下列问题.
(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为C>H>Si.
(3)①甲醇(CH3OH)分子内的O-C-H键角小于(填“大于”、“等于”或“小于”)甲醛(H2C═O)分子内的O-C-H键角.
②ClO2-中心氯原子的杂化轨道类型为,写出CN-的等电子体的分子式N2(写出1个).
③石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为sp2;
(4)根据表中的数据回答问题
①若只考虑相对分子质量,甲醇的沸点应低于-78.2,甲醇沸点高的原因是甲醇分子之间可以形成氢键
②1mol丙烯中所含σ键和π键数目之比为8:1
③一氟甲烷的空间构型为四面体型.
(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为C>H>Si.
(3)①甲醇(CH3OH)分子内的O-C-H键角小于(填“大于”、“等于”或“小于”)甲醛(H2C═O)分子内的O-C-H键角.
②ClO2-中心氯原子的杂化轨道类型为,写出CN-的等电子体的分子式N2(写出1个).
③石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为sp2;
(4)根据表中的数据回答问题
| 有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
| 相对分子质量 | 32 | 42 | 34 |
| 沸点/℃ | 64.7 | -47.4 | -78.2 |
②1mol丙烯中所含σ键和π键数目之比为8:1
③一氟甲烷的空间构型为四面体型.
11.下列事实可以说明甲烷分子具有正四面体结构的是( )
| A. | CH4没有同分异构体 | B. | CH3Cl没有同分异构体 | ||
| C. | CH2Cl2没有同分异构体 | D. | CCl4没有同分异构体 |

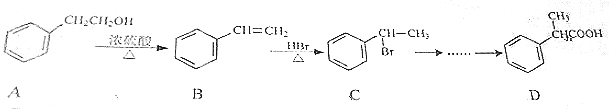
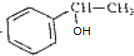
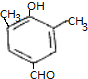 .
.