题目内容
2.下列各组物质中,都是由极性键构成为极性分子的一组的是( )| A. | PCl3和H2S | B. | PCl5和HCl | C. | CH4和H2O | D. | HCN和BF3 |
分析 由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A.PCl3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;H2S中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故A正确;
B.PCl5中含有极性键,空间结构对称,正负电荷的中心重合,属于非极性分子;HCl中含有极性键,正负电荷的中心不重合,属于极性分子,故B错误;
C.CH4中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子;H2O中含有极性键,空间结构为V型,正负电荷的中心不重合,属于极性分子,故C错误;
D.HCN中含有极性键,但结构不对称,正负电荷的中心不重合,属于极性分子;BF3中含有极性键,结构对称,正负电荷的中心重合,属于非极性分子,故D错误.
故选A.
点评 本题考查化学键与分子的极性的关系,难度不大,注意非极性分子的结构对称,正负电荷中心重合来解答,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
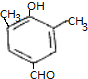
12.香兰素是重要的香料之一,它可由丁香酚合成,如图所示,有关两种化合物的说法正确的是( )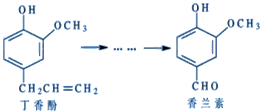

| A. | 常温下,1 mol丁香酚只能与1 mol Br2反应 | |
| B. | 丁香酚不能与FeCl3溶液发生显色反应 | |
| C. | 1 mol香兰素最多能与3 mol氢气发生加成反应 | |
| D. | 香兰素分子中至少有12个原子共平面 |
10.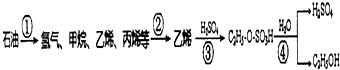 以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
 以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )
以石油为原料制备乙醇的转化流程图如下所示:跟如图流程图相关的说法中正确的是( )| A. | 流程图①中产物均为烃类,产物均为可燃性气体 | |
| B. | 流程图①中需减压分馏,②中需分馏分离出乙烯 | |
| C. | 流程图③中发生加成反应,④中发生取代反应 | |
| D. | 乙醇、硫酸都能够使蛋白质变性,都可用于皮肤消毒 |
17.煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应方程式为:4FeS2+11O2=2Fe2O3+8SO2,为了提高SO2的生成速率,下列措施可行的( )
| A. | 增加硫铁矿石的投入量 | B. | 增加炉的高度 | ||
| C. | 降低温度 | D. | 升高温度 |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 遇到石蕊试液变红的溶液:Na+、NH4+、K+、NO3- | |
| B. | 遇[Fe(CN)6]3-产生蓝色沉淀的溶液:Ca 2+、Cl-、ClO-、Fe3+ | |
| C. | 水电离出的c(OH-)=1×10-12 mol/L的溶液:S2O3-、Cl-、NO3-、Na+ | |
| D. | 与铝反应产生大量氢气的溶液:Ba 2+、HCO3-、I-、Fe3+ |
14.现有甲、乙两种易溶于水的化合物,已知甲的水溶液不导电,乙的水溶液能导电,下列有关说法正确的是( )
| A. | 甲一定是共价化合物,乙一定是离子化合物 | |
| B. | 甲一定是共价化合物,乙可能是共价化合物 | |
| C. | 甲可能是离子化合物,乙可能是共价化合物 | |
| D. | 甲一定是离子化合物,乙可能是共价化合物 |
7.某无色溶液中能大量共存的离子组是( )
| A. | Na+、OH-、Cu2+ | B. | H+、SO42-、HCO3- | C. | SO42-、Cl-、Na+ | D. | Ca2+、Cl-、CO32- |
 .
.