题目内容
由短周期元素组成的中学化学常见无机物A、B、C、D存在如图转化关系(部分生成物和反应条件略去)如图1:
(1)若D是Na2CO3,则B的电子式可能是 .
(2)若C为白色沉淀,且A为强碱,写出B与D反应的离子方程式 .
(3)若A为黑色固体单质,D为常见的液态化合物,且B与D生成C的反应为可逆反应,将不同量的B(g)和D(g)分别通入到体积为2L的恒容密闭容器中,进行反应得到如下三组数据:
①实验1中以v(B)表示的反应速率为 (精确至0.01)
②该反应正向为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= .
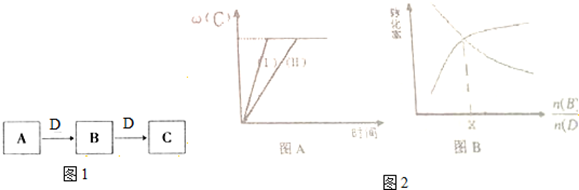
③实验2条件下达到平衡时C的体积分数ω(C)随时间变化如图A(Ⅱ)所示;若改变反应条件,在某条件下ω(C)的变化如图2中的图A中曲线(Ⅰ)所示,则该条件可能是 (填字母).
a、恒容条件下,升高温度
b、恒容条件下,降低温度
c、恒温条件下,缩小反应容器体积
d、恒温条件下,扩大反应容器体积
e、恒温恒容条件下,加入适当催化剂
④若B和D的转化率随
的增加而改变的情况如2中的图B所示,则x= .
(1)若D是Na2CO3,则B的电子式可能是
(2)若C为白色沉淀,且A为强碱,写出B与D反应的离子方程式
(3)若A为黑色固体单质,D为常见的液态化合物,且B与D生成C的反应为可逆反应,将不同量的B(g)和D(g)分别通入到体积为2L的恒容密闭容器中,进行反应得到如下三组数据:
| 实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| B | D | C | B | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应正向为
③实验2条件下达到平衡时C的体积分数ω(C)随时间变化如图A(Ⅱ)所示;若改变反应条件,在某条件下ω(C)的变化如图2中的图A中曲线(Ⅰ)所示,则该条件可能是
a、恒容条件下,升高温度
b、恒容条件下,降低温度
c、恒温条件下,缩小反应容器体积
d、恒温条件下,扩大反应容器体积
e、恒温恒容条件下,加入适当催化剂
④若B和D的转化率随
| n(B) |
| n(D) |

考点:无机物的推断,化学平衡的影响因素
专题:推断题
分析:(1)若D是Na2CO3,则A为酸,B为CO2,C为NaHCO3,据此分析;
(2)X为含铝离子的盐,则B含有[Al(0H)4]-,C为Al(0H)3沉淀;
①据v=
求算;
②温度升高CO的平衡量减少,平衡正向移动,正反应吸热;利用三段式法求出平衡浓度,据K=
求算;
③ω(C)不变,达到平衡所用时间缩短,条件的改变使反应速率加快,平衡没有发生移动,据此分析;
④反应CO+H2O=CO2+H2中,当两种反应物的转化率相等时,加入的两种反应物的物质的量之比必须是1:1.
(2)X为含铝离子的盐,则B含有[Al(0H)4]-,C为Al(0H)3沉淀;
①据v=
| ||
| △t |
②温度升高CO的平衡量减少,平衡正向移动,正反应吸热;利用三段式法求出平衡浓度,据K=
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
③ω(C)不变,达到平衡所用时间缩短,条件的改变使反应速率加快,平衡没有发生移动,据此分析;
④反应CO+H2O=CO2+H2中,当两种反应物的转化率相等时,加入的两种反应物的物质的量之比必须是1:1.
解答:
解:(1)若D是Na2CO3,则A为酸,B为CO2,C为NaHCO3,CO2的电子式为 ,故答案为:
,故答案为: ;
;
(2)X为含铝离子的盐,则B含有[Al(0H)4]-,C为Al(0H)3沉淀,Al3+与[Al(0H)4]-反应的离子方程式为:Al3++3[Al(0H)4]-=4Al(0H)3↓,故答案为:Al3++3[Al(0H)4]-=4Al(0H)3↓;
(3)据已知条件,A为C,D为水,B为CO,C为CO2,反应方程式为:CO+H2O=CO2+H2,
①v=
=1.60mol/(L?min),故答案为:1.60mol/(L?min);
②温度升高CO的平衡量减少,平衡正向移动,正反应吸热;
CO+H2O=CO2+H2
起始量(mol/L)1 0.5 0 0
转化量(mol/L)0.20.2 0.2 0.2
平衡量(mol/L)0.8 0.3 0.2 0.2
据K=
=
=
,故答案为:吸;
;
③ω(C)不变,达到平衡所用时间缩短,条件的改变使反应速率加快,平衡没有发生移动,一定不是改变温度,反应前后气体体积不变,所以可以是压缩容器体积增大压强或使用催化剂,
故答案为:ce;
④反应CO+H2O=CO2+H2中,当两种反应物的转化率相等时,加入的两种反应物的物质的量之比必须是1:1,所以x=1,故答案为:1.
 ,故答案为:
,故答案为: ;
;(2)X为含铝离子的盐,则B含有[Al(0H)4]-,C为Al(0H)3沉淀,Al3+与[Al(0H)4]-反应的离子方程式为:Al3++3[Al(0H)4]-=4Al(0H)3↓,故答案为:Al3++3[Al(0H)4]-=4Al(0H)3↓;
(3)据已知条件,A为C,D为水,B为CO,C为CO2,反应方程式为:CO+H2O=CO2+H2,
①v=
| ||
| 6min |
②温度升高CO的平衡量减少,平衡正向移动,正反应吸热;
CO+H2O=CO2+H2
起始量(mol/L)1 0.5 0 0
转化量(mol/L)0.20.2 0.2 0.2
平衡量(mol/L)0.8 0.3 0.2 0.2
据K=
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
| 0.2×0.2 |
| 0.8×0.3 |
| 1 |
| 6 |
| 1 |
| 6 |
③ω(C)不变,达到平衡所用时间缩短,条件的改变使反应速率加快,平衡没有发生移动,一定不是改变温度,反应前后气体体积不变,所以可以是压缩容器体积增大压强或使用催化剂,
故答案为:ce;
④反应CO+H2O=CO2+H2中,当两种反应物的转化率相等时,加入的两种反应物的物质的量之比必须是1:1,所以x=1,故答案为:1.
点评:本题考查了常见元素化合物的推断,并结合了化学反应速率的求算、平衡移动、化学反应速率、平衡常数的计算等主干知识,题目出的不错.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
向50mL 18mol/L H2SO4溶液中加入足量的锌粒(可加热)充分反应后生成的气体的物质的量为( )
| A、小于0.45mol |
| B、等于0.45mol |
| C、在0.45mol和0.90mol之间 |
| D、等于0.90mol |
下列溶液中Cl-的物质的量浓度与l00mL,1mol/L MgCl2溶液中Cl-的物质的量浓度相同的是( )
| A、50mL 2mol/LCaCl2溶液 |
| B、100mL 2mol/LNaCl溶液 |
| C、50mL 4mol/LCaCl2溶液 |
| D、100mL 1mol/LNaCl溶液 |
下列离子方程式书写不正确的是( )
| A、将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C、氯化铁溶液与铁反应:2Fe3++Fe=3Fe2+ |
| D、碳酸钙中滴加盐酸:CO32-+2H+=CO2↑+H2O |
有机物E的名称是( )
| A、丁烷 | B、异丁烷 |
| C、异丁烯 | D、丁烯 |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液得到9克沉淀,对样品所含杂质的正确判断是( )
| A、肯定没有KNO3 |
| B、肯定没有Ba(NO3)2和KNO3 |
| C、肯定没有Ba(NO3)2,可能有Na2CO3 |
| D、肯定没有Ba(NO3)2,可能有KNO3 |
 (1)下列物质中可以作为燃料电池的负极反应物的是
(1)下列物质中可以作为燃料电池的负极反应物的是 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.