题目内容
7.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA | |
| B. | 1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA | |
| C. | 标准状况下,2.24LCCl4含碳原子数目为0.1NA | |
| D. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目为0.2NA |
分析 A、氧气和臭氧均由氧原子构成;
B、醋酸为弱电解质,不能完全电离;
C、标况下四氯化碳为液态;
D、常温常压下气体摩尔体积大于22.4L/mol.
解答 解:A、氧气和臭氧均由氧原子构成,故3.2g氧气和臭氧混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,个数为0.2NA个,故A正确;
B、醋酸为弱电解质,不能完全电离,故溶液中的氢离子的个数小于0.1NA个,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的碳原子的个数,故C错误;
D、常温常压下气体摩尔体积大于22.4L/mol,故2.24L混合气体的物质的量小于0.1mol,则含有的碳原子个数小于0.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2•yCuCO3.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L-1的Cu(NO3)2溶液、2.0mL 0.50mol•L-1的NaOH溶液和0.25mol•L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的最佳条件是n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃.
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是Cu(OH)2受热分解为CuO.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用如图所示的装置(夹持仪器省略)进行实验:
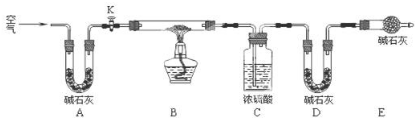
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:(请补充该步操作内容).
步骤5:称量相关装置的质量.
①装置A的作用是;若无装置E,则实验测定的$\frac{x}{y}$的值将偏小(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定$\frac{x}{y}$的值,请你选用合适数据进行计算,并根据你的计算结果,写出该样品组成的化学式.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L-1的Cu(NO3)2溶液、2.0mL 0.50mol•L-1的NaOH溶液和0.25mol•L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃.
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是Cu(OH)2受热分解为CuO.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用如图所示的装置(夹持仪器省略)进行实验:

步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:(请补充该步操作内容).
步骤5:称量相关装置的质量.
①装置A的作用是;若无装置E,则实验测定的$\frac{x}{y}$的值将偏小(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定$\frac{x}{y}$的值,请你选用合适数据进行计算,并根据你的计算结果,写出该样品组成的化学式.
18.下列离子方程式中,正确的是( )
| A. | 向水中加入金属钠:Na+H2O═Na++OH-+H2↑ | |
| B. | 用NaOH溶液检验NH4Cl溶液中的铵根离子:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 用食醋除去水瓶中的水垢:CO${\;}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O |
15.下列两种物质作用时,反应条件或反应物的用量比改变,生成的化合物不会改变的( )
| A. | 钠与氧气 | B. | 氢氧化钠与二氧化碳反应 | ||
| C. | 氧化钠与水反应 | D. | 木炭(C)和O2 |
12.保护环境是每一个公民的责任,下列做法不利于保护环境的是( )
| A. | 开展煤的综合利用 | B. | 开发和利用太阳能 | ||
| C. | 推广使用无氟冰箱 | D. | 用火力发电代替风力发电 |
19.如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质).将所选答案的编号填入下表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着).可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
| 固体混合物 | 所选试剂 | 所选操作 | |
| (1) | CaCO3(SiO2) | ||
| (2) | NaCl(SiO2) | ||
| (3) | SiO2(Fe2O3) | ||
| (4) | SiO2(CaCO3) | ||
| (5) | SiO2(NH4Cl) |
2.理论上不能用于设计成原电池的反应是( )
| A. | HCl+NaOH═NaCl+H2O△H<0 | |
| B. | 2CH3OH(l)+3O2(g)$\stackrel{点燃}{→}$2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
3.下列说法正确的是( )
| A. | 糖类都能发生水解反应 | |
| B. | 油脂有油和脂之分,但都属于酯 | |
| C. | 糖类 油脂 蛋白质 都是高分子化合物 | |
| D. | 糖类 油脂 蛋白质都只含有碳氢氧 三种元素 |
