题目内容
下列反应中水起还原剂作用的是( )
| A、CaO+H2O=Ca(OH)2 | ||||
B、C+H2O(g)
| ||||
| C、2F2+2H2O=4HF+O2 | ||||
| D、3NO2+H2O=2HNO3+NO |
考点:氧化还原反应
专题:
分析:在氧化还原反应中,水起还原剂作用,则水中O元素的化合价在反应中升高,据此分析.
解答:
解:A、CaO+H2O=Ca(OH)2,没有元素化合价的变化,不是氧化还原反应,故A不选;
B、C+H2O(g)
CO+H2,反应中H元素的化合价降低,水作氧化剂,故B不选;
C、2F2+2H2O=4HF+O2的反应中,F元素的化合价降低,水中O元素的化合价升高,则水作还原剂,故C选;
D、3NO2+H2O=2HNO3+NO的反应中,N元素的化合价既有升高的又有降低的,水中的氢、氧元素的化合价都不变,所以水既不是氧化剂又不是还原剂,故D不选;
故选C.
B、C+H2O(g)
| ||
C、2F2+2H2O=4HF+O2的反应中,F元素的化合价降低,水中O元素的化合价升高,则水作还原剂,故C选;
D、3NO2+H2O=2HNO3+NO的反应中,N元素的化合价既有升高的又有降低的,水中的氢、氧元素的化合价都不变,所以水既不是氧化剂又不是还原剂,故D不选;
故选C.
点评:本题考查氧化还原反应中的氧化剂、还原剂判断,明确元素的化合价及化合价在反应中的变化是解答本题的关键,难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列叙述正确的是( )
| A、电解质的电离是在通电的条件下进行的 |
| B、强电解质溶液的导电能力不一定比弱电解质溶液强 |
| C、盐酸是强电解质,所以盐酸中没有HCl分子 |
| D、H2O(g)═H2O(l)是放热反应 |
根据下列化学方程式判断物质氧化性或还原性强弱排序正确的是( )
①2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu.
①2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu.
| A、还原性:Fe>Cu>FeCl2 |
| B、还原性:Fe>FeCl2>Cu |
| C、氧化性:CuCl2>FeCl3>FeCl2 |
| D、氧化性:FeCl3>FeCl2>CuCl2 |
新型纳米材料MFe2Ox(3<X<4)中,M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如下:MFe2Ox
MFe2Oy则下列判断正确的是( )
| 常温下 |
| SO2 |
| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、X>Y |
| D、氧化性:MFe2Ox>SO2 |
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
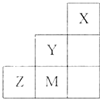

| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |
 有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-.取该溶液进行以下实验:
有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-.取该溶液进行以下实验: