题目内容
18.A、B、C、D、E为原子序数依次增大的五种短周期元素,已知A的最外层电子数等于其电子层数,A单质在常温下为气体,C与B、E在元素周期表中均处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31.D是其所在周期中原子半径最大的.回答下列问题:(1)B、C、E的简单氢化物中稳定性最强的是H2O(填化学式).C、E形成的某种氧化物能使溴水褪色,写出该反应的化学方程式:SO2+Br2+2H2O=H2SO4+2HBr
(2)B、C、D形成的简单离子半径由大到小的顺序为N3->O2->Na+(用离子符号表示).
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为
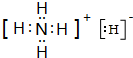 该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2
该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2(4)用离子方程式解释C、D及碳元素组成的六原子正盐的水溶液呈碱性的原因:CO32-+H2O?HCO3-+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况下)气体(不考虑气体溶解)时放热6.32J,写出该反应的热化学方程式:Na2CO3(aq)+H2SO4(aq)=Na2SO4(aq)+CO2(g)+H2O(l)△H=-12.64kJ/mol.
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,A的最外层电子数等于其电子层数,A单质在常温下为气体,则A为H元素;D是其所在周期中原子半径最大的,则D处于IA族,结合原子序数可知,D处于第三周期,故D为Na,则B、C处于第二周期,E处于第三周期,C与B、E在元素周期表中均处于相邻位置,可知C、E同主族,这三种元素原子的最外层电子数之和为17,设B的最外层电子数为x,则C、E最外层电子数为x+1,故x+x+1+x+1=17,解得x=5,故B为N元素、C为O元素、E为S元素,三元素质子数之和为31,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,A的最外层电子数等于其电子层数,A单质在常温下为气体,则A为H元素;D是其所在周期中原子半径最大的,则D处于IA族,结合原子序数可知,D处于第三周期,故D为Na,则B、C处于第二周期,E处于第三周期,C与B、E在元素周期表中均处于相邻位置,可知C、E同主族,这三种元素原子的最外层电子数之和为17,设B的最外层电子数为x,则C、E最外层电子数为x+1,故x+x+1+x+1=17,解得x=5,故B为N元素、C为O元素、E为S元素,三元素质子数之和为31.
(1)N、O、S三元素中O元素非金属性最强,故简单氢化物中稳定性最强的是H2O,O、S形成的某种氧化物能使溴水褪色,该氧化物为SO2,该反应的化学方程式:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:H2O;SO2+Br2+2H2O=H2SO4+2HBr;
(2)B、C、D形成的简单离子为N3-、O2-、Na+,离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->O2->Na+,
故答案为:N3->O2->Na+;
(3)H与N能形成离子化合物H5N中既含离子键又含共价键,该化合物为NH4H,其电子式为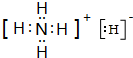 ,该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是:NH3、H2,
,该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是:NH3、H2,
故答案为: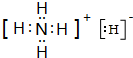 ;NH3、H2;
;NH3、H2;
(4)O、Na及碳元素组成的六原子正盐为Na2CO3,水溶液呈碱性的原因:CO32-+H2O?HCO3-+OH-,该盐溶液与足量稀硫酸混合生成二氧化碳物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,生成1mol二氧化碳放出的热量为6.32kJ×$\frac{1mol}{0.5mol}$=12.64,反应热化学方程式为:Na2CO3(aq)+H2SO4(aq)=Na2SO4(aq)+CO2(g)+H2O(l)△H=-12.64kJ/mol,
故答案为:CO32-+H2O?HCO3-+OH-;Na2CO3(aq)+H2SO4(aq)=Na2SO4(aq)+CO2(g)+H2O(l)△H=-12.64kJ/mol.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,较好的考查学生分析推理能力、知识迁移应用能力.

| A. | 脂肪(由碳、氢、氧元素组成)在人体内代谢的最终产物是CO2和H2O | |
| B. | 蛋白质水解最终产物是葡萄糖 | |
| C. | 人的胃液中含有盐酸,可以帮助消化食物 | |
| D. | 煤气中毒主要是CO与血红蛋白牢固结合,使血红蛋白失去输氧能力 |
| A. | 摩尔是国际上规定的七个基本物理量之一 | |
| B. | 一定温度、压强下,气体体积由其物质的量的多少决定 | |
| C. | 不同的气体,若体积不等,则它们所含的分子数一定不等 | |
| D. | 体积为22.4L的O2,其质量可能为32g |
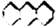 .其二氯代物的同分异构体共有(不考虑立体异构)( )
.其二氯代物的同分异构体共有(不考虑立体异构)( )| A. | 14种 | B. | 15种 | C. | 16种 | D. | 17种 |
 溶液,它们的pH值由大到小的排列顺序是( )
溶液,它们的pH值由大到小的排列顺序是( )| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①>②>③>④ | D. | ④>③>①>② |
