题目内容
5.相同温度、浓度均为0.2mol•L-1 的①CH3COONa、②NaHSO4、③NaCl、④ 溶液,它们的pH值由大到小的排列顺序是( )
溶液,它们的pH值由大到小的排列顺序是( )| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①>②>③>④ | D. | ④>③>①>② |
分析 ②NaHSO4是由于电离导致溶液显酸性;③NaCl是强酸强碱盐,不能水解,溶液显中性;而①CH3COONa、④ 均是由于水解导致溶液显碱性,根据酸越弱,对应的盐就越水解来分析.
均是由于水解导致溶液显碱性,根据酸越弱,对应的盐就越水解来分析.
解答 解:②NaHSO4为强酸的酸式盐,水溶液呈酸性,
③NaCl为强酸强碱盐,溶液呈中性,
①CH3COONa、④ 为弱酸强碱盐,溶液呈碱性,
为弱酸强碱盐,溶液呈碱性,
由于醋酸的酸性比苯酚强,则等浓度时,溶液的pH为④>①,
所以pH值由大到小的顺序为④>①>③>②,
故选A.
点评 本题考查溶液PH的大小比较,题目难度不大,注意盐类水解程度的比较.

练习册系列答案
相关题目
16.大气中的SO2是造成酸雨的主要污染物.最新研究表明,离子晶体[N(CH3)4]2SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:
[N(CH3)4]2SO4(s)+SO2(g)?[N(CH3)4]2S2O6(s)
下列说法正确的是( )
[N(CH3)4]2SO4(s)+SO2(g)?[N(CH3)4]2S2O6(s)
下列说法正确的是( )
| A. | [N(CH3)4]+中只含共价键 | B. | 该反应中,SO2作氧化剂 | ||
| C. | SO2漂白品红是利用其强氧化性 |
13.将质量为8g的铁棒插入到一定浓度的AgNO3溶液中,充分反应后取出铁棒,经洗涤、干燥、称量得知铁棒的质量增加到16g,参加反应的AgNO3的物质的量为( )
| A. | 0.09mol | B. | 0.1 mol | C. | 0.2 mol | D. | 无法计算 |
20. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s时,用Z表示的反应速率为0.158 mol•(L•s)-1 | |
| B. | 反应开始到10s时,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应的化学方程式为X(g)+Y(g)?2Z(g) | |
| D. | 反应开始到10 s时,Y的转化率为39.5% |
10. 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )| A. | 该物质属于芳香族化合物 | |
| B. | 能发生加成反应、取代反应和酯化反应 | |
| C. | 替米沙坦的分子式为C32H28O2N4 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
15.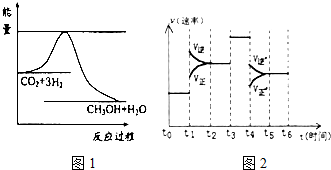 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是d (填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c. v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的逆反应为吸 (填“吸”或“放”)热反应
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是b=2a且a>l (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)图1表示该反应进行过程中能量(单位为kJ?mol.)的变化.
①在体积为1L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是cd (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1大于K2(填“大于”、“等于”或“小于”).
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是d (填字母).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2mol H-O键
c. v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是b=2a且a>l (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)图1表示该反应进行过程中能量(单位为kJ?mol.)的变化.
①在体积为1L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是cd (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图2:其中表示平衡混合物中CH3OH含量最高的一段时间是t0~t1;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1大于K2(填“大于”、“等于”或“小于”).
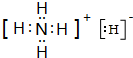 该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2
该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2
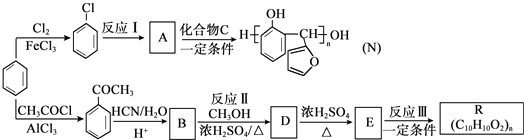

 .
. 生成
生成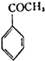 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂.
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂. .
.