题目内容
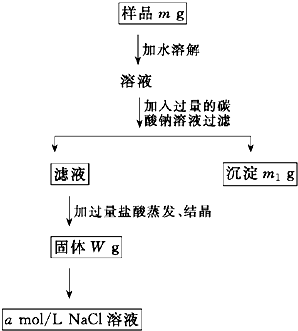 欲用含有少量氯化钙的氯化钠固体,配制100mL a mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:
欲用含有少量氯化钙的氯化钠固体,配制100mL a mol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:(1)称量粗盐样品m g,在托盘天平左盘上放
(2)过滤时,漏斗下端管口应
(3)蒸发操作时应将液体放在
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是
(5)在滤液中加入盐酸的作用是
(6)配制100mL a mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为
考点:溶液的配制
专题:实验题
分析:(1)称量时左物右码;
(2)过滤时“一贴”、“二低”、“三靠”;
(3)蒸发在蒸发皿中进行,当加热到剩有少量液体时停止加热用余热蒸干;
(4)Na2CO3是除杂试剂,加入过量的目的是把杂质除得更干净;
(5)盐酸也是除杂试剂,用于除去所加的过量碳酸钠;
(6)用W g NaCl配制100 mL a mol/L的NaCl溶液应称取NaCl的质量为100 mL×10-3 L/mL×a mol/L×58.5 g/mol=5.85a g,配制溶液时应在100 mL容量瓶中进行定容.
(2)过滤时“一贴”、“二低”、“三靠”;
(3)蒸发在蒸发皿中进行,当加热到剩有少量液体时停止加热用余热蒸干;
(4)Na2CO3是除杂试剂,加入过量的目的是把杂质除得更干净;
(5)盐酸也是除杂试剂,用于除去所加的过量碳酸钠;
(6)用W g NaCl配制100 mL a mol/L的NaCl溶液应称取NaCl的质量为100 mL×10-3 L/mL×a mol/L×58.5 g/mol=5.85a g,配制溶液时应在100 mL容量瓶中进行定容.
解答:
解:(1)称量时左物右码,因此粗盐放在托盘天平的左盘,砝码放在托盘天平的右盘,
故答案为:粗盐;砝码;
(2)过滤时,漏斗下端管口应靠在烧杯内壁上,漏斗里液面应低于滤纸的边缘,
故答案为:靠在烧杯内壁上;低于滤纸的边缘;
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热,
故答案为:蒸发皿;剩余较少液体;
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是除掉钙离子,反应的化学方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl,
故答案为:使钙离子完全形成沉淀而除去;CaCl2+Na2CO3═CaCO3↓+2NaCl;
(5)在滤液中加入盐酸的作用是除掉过量的除杂试剂Na2CO3,反应的化学方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:除去过量的Na2CO3;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(6)配制100mL a mol/L的NaCl溶液时,n(NaCl)=0.1×a mol,m(NaCl)=0.1×a mol×58.5g/mol=5.85a g,选用100ml容量瓶配制,
故答案为:5.85a;100 mL容量瓶.
故答案为:粗盐;砝码;
(2)过滤时,漏斗下端管口应靠在烧杯内壁上,漏斗里液面应低于滤纸的边缘,
故答案为:靠在烧杯内壁上;低于滤纸的边缘;
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热,
故答案为:蒸发皿;剩余较少液体;
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是除掉钙离子,反应的化学方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl,
故答案为:使钙离子完全形成沉淀而除去;CaCl2+Na2CO3═CaCO3↓+2NaCl;
(5)在滤液中加入盐酸的作用是除掉过量的除杂试剂Na2CO3,反应的化学方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:除去过量的Na2CO3;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(6)配制100mL a mol/L的NaCl溶液时,n(NaCl)=0.1×a mol,m(NaCl)=0.1×a mol×58.5g/mol=5.85a g,选用100ml容量瓶配制,
故答案为:5.85a;100 mL容量瓶.
点评:本题考查离子方程式和化学方程式的书写、基本实验操作等知识点,难度不大,配置一定物质的量浓度的溶液中溶质的计算是难点.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
下列图示实验正确的是( )
A、 碳酸氢钠受热分解 |
B、 除去CO2中HCl |
C、 制备乙酸乙酯 |
D、 制备收集干燥的氨气 |
下列物质不能用于鉴别碳酸钠溶液和碳酸氢钠溶液的是( )
| A、稀盐酸 | B、氯化钙溶液 |
| C、澄清石灰水 | D、稀硫酸 |
足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )
| A、氢氧化钠溶液 | B、稀硫酸 |
| C、盐酸 | D、水 |
一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)?2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
| A、以X浓度变化表示的反应速率为0.25 mol?L-1?s-1 |
| B、12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的1/5 |
| C、若增大X的浓度,则物质Y的转化率减小 |
| D、若该反应的△H<0,升高温度,平衡常数K减小 |
