题目内容
5.硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下: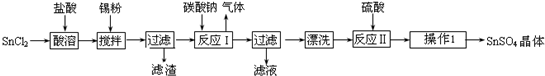
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡(Sn(OH)Cl).
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是第五周期第ⅣA族.
(2)写出SnCl2水解的化学方程式SnCl2+H2O?Sn(OH)Cl+HCl.
(3)加入Sn粉的作用有两个:①调节溶液pH ②防止Sn2+被氧化.
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是Sn2++CO32-═SnO↓+CO2↑.
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是Sn2++H2O2+2H+═Sn4++2H2O.
分析 为防止SnCl2水解,所以将SnCl2溶解在稀盐酸中,然后加入锡粉搅拌,防止Sn2+被氧化,然后过滤滤去滤渣,向滤液中加入碳酸钠,发生反应Sn2++CO32-═SnO↓+CO2↑,然后过滤得到滤渣,将滤渣洗涤,用硫酸溶解得到硫酸锡,将硫酸锡溶液蒸发浓缩、冷却结晶、干燥得到硫酸锡固体;
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,根据原子序数减去各周期容纳元素种数确定所在的周期;
(2)SnCl2易水解生成碱式氯化亚锡(Sn(OH)Cl);
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水.
解答 解:为防止SnCl2水解,所以将SnCl2溶解在稀盐酸中,然后加入锡粉搅拌,防止Sn2+被氧化,然后过滤滤去滤渣,向滤液中加入碳酸钠,发生反应Sn2++CO32-═SnO↓+CO2↑,然后过滤得到滤渣,将滤渣洗涤,用硫酸溶解得到硫酸锡,将硫酸锡溶液蒸发浓缩、冷却结晶、干燥得到硫酸锡固体;
(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期,则在周期表中的位置为:第五周期第ⅣA族,
故答案为:第五周期第ⅣA族;
(2)SnCl2易水解生成碱式氯化亚锡(Sn(OH)Cl),水解方程式为SnCl2+H2O?Sn(OH)Cl+HCl,
故答案为:SnCl2+H2O?Sn(OH)Cl+HCl;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O.
点评 本题以SnSO4制备为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写等知识点,侧重考查学生知识综合应用能力,需要学生具备综合知识并灵活解答,题目难度不大.

①Na2CO3溶液跟CaCl2溶液反应得到白色沉淀
②Na2CO3溶液和NaHCO3溶液都能跟Ca(OH)2溶液反应得到白色沉淀
③Na2O2可作供氧剂,而Na2O不作供氧剂
④向石蕊试液中加入Na2O2粉末,溶液先变蓝后褪色,并有气泡生成.
| A. | 都正确 | B. | ③④ | C. | ①② | D. | ②③④ |
| A. | 风能是人类通过风车等工具获取的能源,属于一次能源 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 原电池将把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
| A. | 分液、过滤、蒸馏 | B. | 过滤、蒸馏、分液 | C. | 分液、蒸馏、过滤 | D. | 蒸馏、过滤、分液 |

| A. | 反应Ⅰ主要为2NaOH+Cl2═NaCl+NaClO+H2O 反应Ⅱ的离子方程式为3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O | |
| B. | 加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 调节pH析出的沉淀为高铁酸钠,用异丙醇洗涤的主要目的是有利于产品干燥 | |
| D. | 高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3有吸附性,有絮凝作用 |
①Cl2 ②铜 ③CaO ④CO2
⑤Ba(OH)2 ⑥淀粉溶液 ⑦HClO ⑧浓硫酸
(1)把上述各物质按物质的分类方法填写在表格的空白处(填物质编号):
| 分类标准 | 碱性氧化物 | 非电解质 | 弱酸 | 胶体 |
| 属于该类的物质 |
(3)⑤在水中的电离方程式为Ba(OH)2=Ba2++2OH-.
(4)②与⑧发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
该反应中氧化剂和还原剂的物质的量之比为1:1.

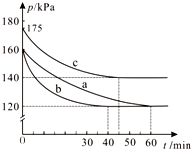 PCl3和Cl2在一定条件下反应生成PCl5.
PCl3和Cl2在一定条件下反应生成PCl5.