题目内容
10.胆矾(CuSO4•5H2O)是铜的重要化合物,有着广泛的应用,如用来配制农药波尔多液.以下是CuSO4•5H2O的实验室制备流程图.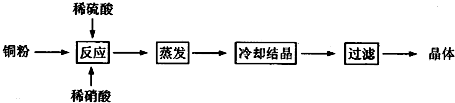
根据题意完成下列填空:
(1)向含有铜粉的稀硫酸中滴加硝酸,在铜粉溶解时最终可以观察到的实验现象:溶液呈蓝色、有红棕色气体生成.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是Cu(NO3)2 (填化学式).
(3)将CuSO4•5H2O与NaHCO3按一定的比例共同投入到150mL沸水中,剧烈搅拌,冷却后,有绿色晶体析出.该晶体的化学组成为Cux(OH) y(CO3) z•nH2O.实验所得的绿色晶体需充分洗涤,检验是否洗涤干净的方法是取最后一次洗涤液少许与试管中,加入盐酸酸化的BaCl2溶液,若没有白色沉淀生产,则洗涤干净.
(4)为了确定晶体的化学式,某实验小组进行如下实验:
a.称取3.640g晶体,加入足量的稀盐酸使固体完全溶解,收集到标准状况下的气体448.0mL;
b.称取等质量的晶体,灼烧至完全分解,得到2.400g残余固体.通过计算确定晶体的化学式(写出计算过程).
分析 (1)铜与浓硝酸反应有硝酸铜和红棕色的二氧化氮产生,根据反应的产物判断现象;
(2)制硫酸铜时,用铜与硝酸、硫酸的混合物反应的,所以可根据反应物判断可能存在的杂质;
(3)将CuSO4•5H2O与NaHCO3按一定的比例反应得到绿色晶体,所以绿色晶体析出的时候表面应有硫酸根离子,可以通过检验硫酸根离子判断是否洗涤干净;
(4)称取3.640g晶体,加入足量的稀盐酸使固体完全溶解,收集到标准状况下的气体448.0mL,即为0.02mol应为二氧化碳气体,由此可计算出碳酸根的物质的量,取等质量的晶体,灼烧至完全分解,得到2.400g残余固体应为氧化铜,由此计算出晶体中铜元素的质量及物质的量,根据电荷守恒可确定氢氧化根的物质的量,再由总质量及铜元素的质量、碳酸根的质量、氢氧根的质量确定结晶水的质量,进而确定晶体的组成;
解答 解:(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,观察到溶液呈蓝色、有红棕色气体生成,
故答案为:溶液呈蓝色;有红棕色气体生成;
(2)制硫酸铜时,用铜与硝酸、硫酸的混合物反应的,铜与硝酸能生成硝酸铜,所以可能混有硝酸铜杂质,化学式为Cu(NO3)2,
故答案为:Cu(NO3)2;
(3)将CuSO4•5H2O与NaHCO3按一定的比例反应得到绿色晶体,所以绿色晶体析出的时候表面应有硫酸根离子,可以通过检验硫酸根离子判断是否洗涤干净,检验的方法是取最后一次洗涤液少许与试管中,加入盐酸酸化的BaCl2溶液,若没有白色沉淀生产,则洗涤干净,
故答案为:取最后一次洗涤液少许与试管中,加入盐酸酸化的BaCl2溶液,若没有白色沉淀生产,则洗涤干净;
(4)由题意可知:n(CO32-)=n(CO2)=0.448L∕22.4mol•L-1=0.02 mol,
灼烧最终得到的固体是CuO,
n(Cu2+)=n(CuO)=2.400 g/80 g•mol-1=0.03 mol,
根据电荷守恒:n(Cu2+)×2=n(OH-)+n(CO32-)×2,
所以n(OH-)=n(Cu2+)×2-n(CO32-)×2=0.03 mol×2-0.02 mol×2=0.02 mol
n(H2O)=(3.640g-0.03mol×64g•mol-1-0.02mol×17g•mol-1-0.02mol×60g•mol-1)/18g•mol-1=0.01mol
所以x:y:z:n=0.03mol:0.02mol:0.02mol:0.01mol=3:2:2:1,则晶体的化学式为Cu3(OH)2(CO3)2•H2O或Cu(OH)2•2CuCO3•H2O,
答:晶体的化学式为Cu3(OH)2(CO3)2•H2O或Cu(OH)2•2CuCO3•H2O.
点评 本题考查了物质含量的测定、实验现象等观察、实验原理的分析等,题目难度中等,侧重于考查学生的实验探究能力和计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++CO32- | |
| B. | 过量的CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |

| A. | 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 |
 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(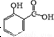 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
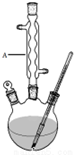
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入.
(2)制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(3)实验中加入甲苯对合成水杨酸甲酯的作用是加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(或水洗分液).
(5)实验中加入无水硫酸镁的作用是除水或干燥.本实验的产率为60%(保留两位有效数字).
三氯甲烷$\stackrel{HF、SbCl_{3}}{→}$二氟一氯甲烷$\stackrel{△}{→}$四氟乙烯$\stackrel{引发剂}{→}$聚四氟乙烯
下列说法中,不正确的是( )
| A. | “塑料王”聚四氟乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上 | |
| D. | 四氟乙烯 (CF2=CF2)通过加聚反应生成“塑料王”聚四氟乙烯 |
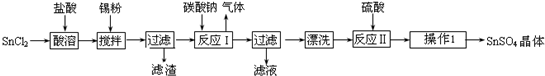
 已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.
已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.