题目内容
18.设NA表示阿伏加德罗常数值.下列说法正确的是( )| A. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO3 2-离子数之和为0.1NA | |
| B. | 标准状况下,22.4LC2H4与C3H6混合气体所含有分子数为NA | |
| C. | 1molNa2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18gNH4+所含的电子数11NA |
分析 A、HCO3-在溶液中既能水解为H2CO3,又能电离为CO32-;
B、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$;
C、过氧化钠与二氧化碳的反应为歧化反应;
D、求出铵根离子的物质的量,然后根据铵根离子为10电子微粒来分析.
解答 解:A、HCO3-在溶液中既能部分水解为H2CO3,又能部分电离为CO32-,故溶液中的HCO3-、H2CO3、CO32-的个数之和为0.1NA个,故A错误;
B、分子数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{22.4L}{22.4L/mol}×{N}_{A}/mol$=NA个,故B正确;
C、过氧化钠与二氧化碳的反应为歧化反应,氧元素的价态由-1变为0和-2,故1mol过氧化钠转移1mol电子即NA个,故C错误;
D、18g铵根离子的物质的量为1mol,而铵根离子为10电子微粒,故1mol铵根离子中含10NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
8.油脂的硬化属于( )
| A. | 氧化反应 | B. | 加成反应 | C. | 取代反应 | D. | 化合反应 |
3.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式可能与事实相符的是( )
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
10.实验是化学研究的基础,下列有关各实验装置图的叙述中,不正确的是( )
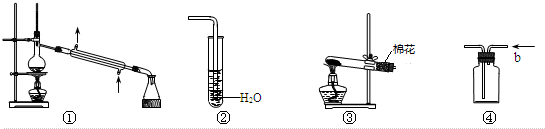

| A. | 装置①可用于除去乙醇中微量的食盐 | |
| B. | 装置②可用于检验CO2气体 | |
| C. | 以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置 | |
| D. | 装置④b口进气可收集H2、N2等气体 |
16.化学与科学、技术、社会、环境密切相关.下列有关说法不正确的是( )
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 | |
| B. | 高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” | |
| C. | 煤经过气化和液化两种物理变化,可变为清洁能源 | |
| D. | 加热能杀死甲型H1N1流感病毒,主要是加热后使病毒中的蛋白质变性 |
17.短周期元素甲、乙、丙、丁的原子序数依次增大,甲的L层电子数是K层的3倍,丁所在族 序数是周期数的2倍,乙、丙、丁的最外层电子数之和为10.下列说法正确的是( )
| A. | 简单离子半径:乙>丙>丁 | |
| B. | 最高价氧化物对应的水化物的碱性:乙>丙 | |
| C. | 简单气态氢化物稳定性:丁>甲 | |
| D. | 甲和丁组成的化合物在熔融状态下可以导电 |