题目内容
10.实验是化学研究的基础,下列有关各实验装置图的叙述中,不正确的是( )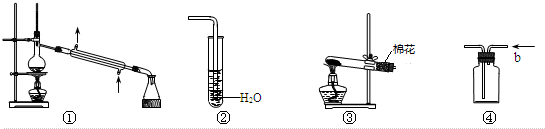
| A. | 装置①可用于除去乙醇中微量的食盐 | |
| B. | 装置②可用于检验CO2气体 | |
| C. | 以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置 | |
| D. | 装置④b口进气可收集H2、N2等气体 |
分析 A.乙醇和食盐的熔沸点相差大,可以采用蒸馏方法分离提纯;
B.二氧化碳在水中溶解没有明显现象;
C.高锰酸钾在加热条件下分解生成氧气;
D.密度小于空气且常温下和空气不反应的气体可以采用向下排空气法收集.
解答 解:A.乙醇和食盐的熔沸点相差大,可以采用蒸馏方法分离提纯,所以装置①可用于除去乙醇中微量的食盐,故A正确;
B.二氧化碳在水中溶解没有明显现象,不能用装置②检验CO2气体,应该用澄清石灰水检验,故B错误;
C.高锰酸钾在加热条件下分解生成氧气,所以以KMnO4为原料,装置③可用于实验室制备少量O2的发生装置,故C正确;
D.密度小于空气且常温下和空气不反应的气体可以采用向下排空气法收集,氢气和氮气密度小于空气且常温下和空气不反应,用向下排空气法收集氢气和氮气,所以装置④b口进气可收集H2、N2等气体,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及气体收集、气体制备、物质分离和提纯等知识点,明确物质性质及物质性质差异性是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.

文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
Ⅲ.NO2和NO都能被KMnO4氧化吸收
Ⅳ.铁氰化钾化学式为K3[Fe(CN)6]:亚铁氰化钾化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓(蓝色沉淀)
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)甲的实验操作中通入CO2的目的是排除反应体系中的空气,防止对产物中有无一氧化氮判断的干扰.
(3)甲取少量B中溶液,加热,棕色溶液变浅绿色,有无色气体逸出,且在空气中变为红棕色其原因是FeSO4+NO?Fe(NO)SO4(棕色)△H<0,正反应放热,加热后,平衡向逆反应方向移动,甲依据该现象得出的结论是A中有NO生成.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,浓硝酸换成稀硝酸浓硝酸换成稀硝酸,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)将A所得溶液稀释至500mL,取少量稀释后的溶液调节pH后,滴加铁氰化钾溶液有蓝色沉淀生成,由此证明A溶液中含有Fe2+(填离子符号).
另取稀释后的溶液25.00mL加入过量的KI固体,充分反应后pH至7左右,滴入几滴淀粉溶液做指示剂,用0.25mo1/L Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液16.00mL.(己知:I2+2S2O32-=2I-+S4O62-),则A中所得溶液的c(Fe3+)=0.16mo1/L.

文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
Ⅲ.NO2和NO都能被KMnO4氧化吸收
Ⅳ.铁氰化钾化学式为K3[Fe(CN)6]:亚铁氰化钾化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓(蓝色沉淀)
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
(1)滴入浓硝酸加热前没有明显现象的原因是常温时,铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生.
(2)甲的实验操作中通入CO2的目的是排除反应体系中的空气,防止对产物中有无一氧化氮判断的干扰.
(3)甲取少量B中溶液,加热,棕色溶液变浅绿色,有无色气体逸出,且在空气中变为红棕色其原因是FeSO4+NO?Fe(NO)SO4(棕色)△H<0,正反应放热,加热后,平衡向逆反应方向移动,甲依据该现象得出的结论是A中有NO生成.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,浓硝酸换成稀硝酸浓硝酸换成稀硝酸,证明有NO生成的实验现象是A中没有红棕色气体生成,B中溶液变为棕色.
(5)将A所得溶液稀释至500mL,取少量稀释后的溶液调节pH后,滴加铁氰化钾溶液有蓝色沉淀生成,由此证明A溶液中含有Fe2+(填离子符号).
另取稀释后的溶液25.00mL加入过量的KI固体,充分反应后pH至7左右,滴入几滴淀粉溶液做指示剂,用0.25mo1/L Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液16.00mL.(己知:I2+2S2O32-=2I-+S4O62-),则A中所得溶液的c(Fe3+)=0.16mo1/L.
18.设NA表示阿伏加德罗常数值.下列说法正确的是( )
| A. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO3 2-离子数之和为0.1NA | |
| B. | 标准状况下,22.4LC2H4与C3H6混合气体所含有分子数为NA | |
| C. | 1molNa2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18gNH4+所含的电子数11NA |
5.NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,4.4g体积比为3:1的CO2和N2O组成的混合气体中所含原子总数为0.3NA | |
| B. | CH4与P4的分子结构均为正四面体形,在1molCH4或P4分子中含有共价键数皆为4NA | |
| C. | 含有NA个阴离子的Na2O溶于水形成1L的溶液中,溶质的物的质量浓度为1mol•L-1 | |
| D. | 标准状况下,5.6L18O2参加反应一定转移NA个e- |
11.已知常温下,几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
某课题组拟以上述矿渣为原料制备金属镁、铝、铜、铁,其部分工艺流程如下:

请回答下列问题:
(1)沉淀Ⅰ的主要用途是导线等(列一种即可),步骤Ⅳ中调节pH范围为3.7-9.3.
(2)由滤液Ⅱ经几步反应可得到需要制备的一种金属的氧化物,滤液Ⅱ中需要通入气体的化学式CO2,反应的化学方程式为NaAlO2+CO2+H2O═NaHCO3+Al(OH)3,2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O.
(3)写出由滤液Ⅰ得到滤液Ⅱ的离子方程式Al3++4OH-═AlO2-+2H2O.
(4)滤液Ⅳ中含有的金属阳离子是Mg2+.
(5)工业上,冶炼铝、铁、铜、镁的方法依次是B(填代号).
A.电解法、热还原法、分解法、分解法 B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 D.热还原法、热还原法、热还原法、电解法
在工业生产中,冶炼这些金属时选择的相应物质的化学式依次是Al2O3、Fe2O3、CuO、MgCl2.
| Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
| 完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |

请回答下列问题:
(1)沉淀Ⅰ的主要用途是导线等(列一种即可),步骤Ⅳ中调节pH范围为3.7-9.3.
(2)由滤液Ⅱ经几步反应可得到需要制备的一种金属的氧化物,滤液Ⅱ中需要通入气体的化学式CO2,反应的化学方程式为NaAlO2+CO2+H2O═NaHCO3+Al(OH)3,2Al(OH)3$\frac{\underline{\;高温\;}}{\;}$Al2O3+3H2O.
(3)写出由滤液Ⅰ得到滤液Ⅱ的离子方程式Al3++4OH-═AlO2-+2H2O.
(4)滤液Ⅳ中含有的金属阳离子是Mg2+.
(5)工业上,冶炼铝、铁、铜、镁的方法依次是B(填代号).
A.电解法、热还原法、分解法、分解法 B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 D.热还原法、热还原法、热还原法、电解法
在工业生产中,冶炼这些金属时选择的相应物质的化学式依次是Al2O3、Fe2O3、CuO、MgCl2.
8.近几年,我国因为汽车尾气对环境的污染日趋严重,清洁能源的燃料电池汽车逐渐进入市场,已知甲烷的燃烧热为分别为890KJ•mol-1,某电池用甲烷作为燃料,电池中以0.6molKOH溶液为电解质溶液,有关这类电池的说法不正确的( )
| A. | 这类电池的正极反应与金属的吸氧腐蚀正极反应相似 | |
| B. | 每转移1mol电子则这种电池产生电能为0.5度电 | |
| C. | 电池的负极反应为:CH4+10OH-═CO32-+7H2O+8e- | |
| D. | 当消耗0.4mol燃料时,电池中的各种离子的浓度关系为:C(K+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) |
9.下列热化学方程式中的△H能表示物质燃烧热的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-110.35kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1 |



 .
.