题目内容
12.在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的$\frac{2}{3}$.把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为0.045mol/L.分析 HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{2}{3}$就停止了,则氯化氢体积=$\frac{2}{3}$VL,溶液体积为$\frac{2}{3}$VL,n(HCl)=$\frac{\frac{2}{3}VL}{22.4L/mol}$=$\frac{2}{3×22.4}$mol,根据c=$\frac{n}{V}$计算盐酸浓度.
解答 解:HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{2}{3}$就停止了,则氯化氢体积=$\frac{2}{3}$VL,溶液体积为$\frac{2}{3}$VL,n(HCl)=$\frac{\frac{2}{3}VL}{22.4L/mol}$=$\frac{2}{3×22.4}$mol,盐酸浓度c=$\frac{n}{V}$=$\frac{\frac{2}{3×22.4}mol}{\frac{2}{3}L}$=$\frac{1}{22.4}$mol/L=0.045mol/L,故答案为:0.045.
点评 本题考查物质的量的有关计算,侧重考查学生分析判断及计算能力,明确水上升体积与HCl气体体积关系是解本题关键,熟悉物质的量公式中各个物理量的关系,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
3.关于常温下pH=2的醋酸,下列叙述正确的是( )
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
20.已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题.
(1)元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是612C.X的另一种同位素可用来测定文物所属年代,这种同位素的原子符号是614C.
(2)Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是O3.
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是NaCl(写化学式).
(4)画出T的原子结构示意图: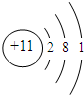 .
.
(5)由X元素组成的单质在Y元素组成的常见单质中燃烧,生成的产物是CO2或CO.
| 元素编号 | 元素性质或原子结构的相关叙述 |
| T | 失去一个电子后,形成与Ne相同的核外电子排布 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
| Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
(2)Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是O3.
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是NaCl(写化学式).
(4)画出T的原子结构示意图:
 .
.(5)由X元素组成的单质在Y元素组成的常见单质中燃烧,生成的产物是CO2或CO.
7.互为同分异构体,且可用银镜反应区别的是( )
| A. | 丙酸和乙酸甲酯 | B. | 蔗糖和麦芽糖 | C. | 麦芽糖和纤维素 | D. | 苯甲酸和苯甲醛 |
1.下列有关离子(或物质)的检验及结论,正确的是( )
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
2. 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,写出该反应的离子方程式2I-+MnO2+4H+=Mn2++I2+2H2O.
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是CD.
A.-1 B.+1 C.+3 D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式IOH?H++IO-.
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(5)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:$\frac{0.108×0.108}{0.78{4}^{2}}$.
②上述反应中,正反应速率为υ正=k正•x2(HI),逆反应速率为υ逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).
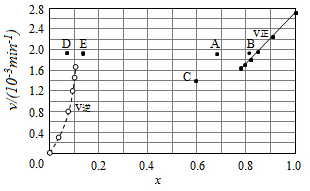
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为AE(填字母).
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,写出该反应的离子方程式2I-+MnO2+4H+=Mn2++I2+2H2O.
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是CD.
A.-1 B.+1 C.+3 D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式IOH?H++IO-.
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(5)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为υ正=k正•x2(HI),逆反应速率为υ逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为AE(填字母).