题目内容
11. 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$.
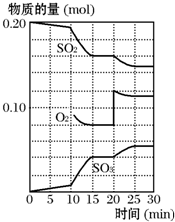
(2)600℃时,在一体积可变的密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间段是15min~20min、25min~30min.
(3)据图判断,反应进行至20min时,曲线发生变化的原因是增大了氧气的物质的量或通入氧气(用文字表达),10min~15min的曲线变化的原因可能是ab(填写编号).
a.加了催化剂 b.缩小容器体积
c.升高温度 d.增加SO3的物质的量
(4)若在15分钟时,保持温度和压强不变,再充入0.2mol SO3(g),则再次达到平衡时,SO3(g)的物质的量与SO2(g)的物质的量的比值将不变(填“变大”、“变小”或“不变”).
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)平衡时SO2、O2、SO3物质的量不变;
(3)反应进行至20min时,氧气的物质的量突然增大,平衡正向移动,二氧化硫的物质的量减小,三氧化硫的物质的量增大;10min~15min的曲线斜率大,反应速率加快;
(4)15分钟时,保持温度和压强不变,由图可知,平衡时SO2、O2、SO3物质的量分别为0.16mol、0.08mol、0.04mol,而保持温度和压强不变,再充入0.2mol SO3(g),浓度不变,平衡不移动.
解答 解:(1)由2SO2(g)+O2(g)?2SO3(g)可知,K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
(2)平衡时SO2、O2、SO3物质的量不变,由图可知反应处于平衡状态的时间段是15min~20min、25min~30min,故答案为:15min~20min、25min~30min;
(3)反应进行至20min时,氧气的物质的量突然增大,平衡正向移动,二氧化硫的物质的量减小,三氧化硫的物质的量增大,曲线发生变化的原因是增大了氧气的物质的量或通入氧气;10min~15min的曲线斜率大,反应速率加快,则a.加了催化剂、b.缩小容器体积均可加快反应速率、且平衡正向移动,c中升高温度平衡逆向移动,d中增大生成物的量,平衡逆向移动,c、d与图象不符,
故答案为:增大了氧气的物质的量或通入氧气;ab;
(4)15分钟时,保持温度和压强不变,由图可知,平衡时SO2、O2、SO3物质的量分别为0.16mol、0.08mol、0.04mol,而保持温度和压强不变,再充入0.2mol SO3(g),浓度不变,平衡不移动,则再次达到平衡时,SO3(g)的物质的量与SO2(g)的物质的量的比值将不变,均为1:4,
故答案为:不变.
点评 本题考查化学平衡的计算,为高频考点,把握K的意义、平衡移动、等效平衡为解答的关键,侧重分析与应用能力的考查,注意平衡移动与图象的结合,(4)为解答的难点,题目难度不大.

| A. | 油脂的主要成分是高级脂肪酸的甘油酯属于酯类 | |
| B. | 油脂易溶于水 | |
| C. | 天然油脂大多由混甘酯分子构成的混合物 | |
| D. | 脂肪里饱和烃基的相对含量较大,熔点 较高 |
①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),计算△H=-262.7kJ•mol-1.反应原料来自煤的气化.已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1.
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol•L-1•min-1.
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表温度(填“温度”或“压强”)判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件
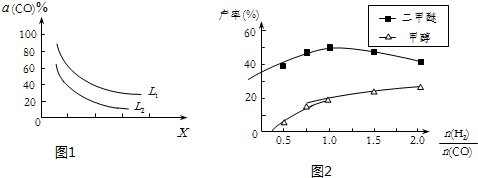
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比$\frac{n({H}_{2})}{n(CO)}$的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小.
| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
| 元素编号 | 元素性质或原子结构的相关叙述 |
| T | 失去一个电子后,形成与Ne相同的核外电子排布 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
| Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
(2)Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是O3.
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是NaCl(写化学式).
(4)画出T的原子结构示意图:
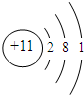 .
.(5)由X元素组成的单质在Y元素组成的常见单质中燃烧,生成的产物是CO2或CO.
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |