题目内容
20.有5种元素X、Y、Z、Q、T.X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )| A. | 元素Y和Q可形成化合物Y2Q3 | |
| B. | T和Z各有一种单质的空间构型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |
分析 5种元素X、Y、Z、Q、T,X原子M层上有2个未成对电子且无空轨道,则X为S元素;
Y原子的特征电子构型为3d64s2,则Y为Fe元素;
Z原子的L电子层的p能级上有一个空轨道,则Z为C元素;
Q原子的L电子层的P能级上只有一对成对电子,则Q是O元素;
T原子的M电子层上p轨道半充满,则T是P元素;
A.Y是Fe元素、Q是O元素,二者形成的氧化物有氧化亚铁、氧化铁和四氧化三铁;
B.T是P元素、Z是C元素,T和Z各有一种单质的空间构型为正四面体形,分别为白磷和金刚石;
C.X是S元素、Q是O元素,非金属元素之间易形成共价键,只含共价键的化合物是共价化合物;
D.ZO2是CO2,只含极性键,且二氧化碳分子结构对称.
解答 解:5种元素X、Y、Z、Q、T,X原子M层上有2个未成对电子且无空轨道,则X为S元素;
Y原子的特征电子构型为3d64s2,则Y为Fe元素;
Z原子的L电子层的p能级上有一个空轨道,则Z为C元素;
Q原子的L电子层的P能级上只有一对成对电子,则Q是O元素;
T原子的M电子层上p轨道半充满,则T是P元素;
A.Y是Fe元素、Q是O元素,二者形成的氧化物有氧化亚铁、氧化铁和四氧化三铁,所以元素Y和Q可形成化合物Fe2O3,故A正确;
B.T是P元素、Z是C元素,T和Z各有一种单质的空间构型为正四面体形,分别为白磷和金刚石,但白磷分子中四个磷原子位于四个顶点上,故B正确;
C.X是S元素、Q是O元素,非金属元素之间易形成共价键,只含共价键的化合物是共价化合物,二氧化硫、三氧化硫中只存在共价键,为共价化合物,故C错误;
D.ZO2是CO2,只含极性键,且二氧化碳分子结构对称,为非极性分子,故D正确;
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,涉及基本概念、物质结构、化合物类型等知识点,明确基本概念内涵及物质结构、原子结构是解本题关键,题目难度不大.

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案| A. | 化学性质相似的有机物一定互为同系物 | |
| B. | 分子组成相差一个或几个CH2原子团的有机物一定互为同系物 | |
| C. | 同系物之间相对分子质量一定相差14的整数倍 | |
| D. | 互为同系物的有机化合物可能互为同分异构体 |
| A. | 加HAc | B. | 加NaAc | C. | 加水 | D. | 加NaOH |
| A. | 8.4g NaHCO3固体中含有的阴阳离子总数为0.2 NA | |
| B. | 标准状况下,22.4L苯中含有的分子数为NA | |
| C. | 通常状况下,NA 个甲烷分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为1mol/L的Na2CO3溶液中,含有CO32-个数为NA |
| A. | 在潮湿的环境下,黄铜(锌铜合金)比纯铜更耐腐蚀 | |
| B. | 向铁棒上镀铜时,铁作阳极,氯化铜溶液作电解质溶液 | |
| C. | 以稀硫酸作电解质溶液,锌铜分别作电极构成的原电池中,锌极上有气泡生成 | |
| D. | 工业上以石墨作电极电解熔融的AlCl3制取Al时,每产生1mol Al,阳极就产生33.6L氯气 |
Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂B.降低反应体系的温度
C.充入氩气使容器内压强增大D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284kJ/mol或△H=-284kJ/mol.
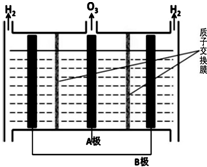
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 金属性:Na>Mg>Ca |
| A. | 最后一定有沉淀生成,且有气体放出 | |
| B. | 溶液最后一定澄清,且有气体放出 | |
| C. | 一定有气体放出 | |
| D. | 一定无气体放出 |
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)(需要写出简单的求解步骤)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)(需要写出简单的求解步骤)