题目内容
10. 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)(需要写出简单的求解步骤)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)(需要写出简单的求解步骤)问:①加入NaOH160mL时沉淀的化学式Mg(OH)2和Al(OH)3;
②合金中Mg的质量;
③a 的值.
分析 由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;再加氢氧化钠,氢氧化铝溶解,所以最后的11.6g沉淀就是氢氧化镁,由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;根据溶解氢氧化铝消耗氢氧化钠溶液的体积可计算出氢氧化铝的物质的量,然后根据m=nM计算出氢氧化铝的质量,从而可知a的值.
解答 解:①根据图象可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,
故答案为:Mg(OH)2和Al(OH)3;
②由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,再加氢氧化钠,氢氧化铝溶解,所以最后的11.6g沉淀就是氢氧化镁,即n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g,
答:合金中Mg的质量为4.8g;
③溶解氢氧化铝沉淀消耗氢氧化钠溶液的体积为:180mL-160mL=20mL,消耗氢氧化钠的物质的量为:5mol/L×0.02L=0.1mol,则n(Al(OH)3)=n(NaoH)=0.1mol,
根据②可知n[Mg(OH)2]=0.2mol,
所以生成氢氧化铝、氢氧化铝的总质量为:0.1mol×78g/mol+0.2mol×58g/mol=19.4g,
答:a的值是19.4.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

| A. | 1.2 mol | B. | 1.5mol | C. | 3.0 mol | D. | 2.0 mol |
| A. | 不能使溴的四氯化碳溶液褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 不能发生加成反应 | D. | 属于高分子化合物 |
| A. | 6和8 | B. | 19和16 | C. | 12和17 | D. | 10和8 |
| A. | X的氢化物溶于水显酸性 | |
| B. | Y的氧化物是离子化合物 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物可发生中和反应 |
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | ②③④⑤ |
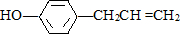 )的下列说法中正确的是( )
)的下列说法中正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 分子中至少有7个碳原子处于同一个平面 | |
| C. | 它的部分同分异构体能与碳酸氢钠溶液反应产生气体 | |
| D. | 1mol该化合物最多可与2molBr2发生反应 |
| A. | 该溶液呈浅黄色 | |
| B. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| C. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 | |
| D. | 该溶液中加入NaOH溶液,生成白色沉淀 |
| A. | 元素Y和Q可形成化合物Y2Q3 | |
| B. | T和Z各有一种单质的空间构型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |