题目内容
5.下列说法正确的是( )| A. | 在潮湿的环境下,黄铜(锌铜合金)比纯铜更耐腐蚀 | |
| B. | 向铁棒上镀铜时,铁作阳极,氯化铜溶液作电解质溶液 | |
| C. | 以稀硫酸作电解质溶液,锌铜分别作电极构成的原电池中,锌极上有气泡生成 | |
| D. | 工业上以石墨作电极电解熔融的AlCl3制取Al时,每产生1mol Al,阳极就产生33.6L氯气 |
分析 A、根据原电池原理分析解答;
B、向铁棒上镀铜时,铜作阳极,电镀时,将镀件金属铁为阴极;
C、锌铜分别作电极构成的原电池中,活泼金属锌为负极,失电子变成锌离子;
D、氯化铝是共价化合物,工业上是电解熔融的氧化铝的方法得到铝.
解答 解:A、黄铜(锌铜合金)中Zn比较Cu活泼,Zn为负极,在潮湿的环境下,Zn首先被腐蚀,Cu被保护,而纯铜在潮湿的环境下,腐蚀化学腐蚀,故黄铜更耐腐蚀,故A正确;
B、向铁棒上镀铜时,铜作阳极,电镀时,将镀件金属铁为阴极,电解质含有镀层金属离子的电解质溶液,故B错误;
C、锌铜分别作电极构成的原电池中,活泼金属锌为负极,失电子变成锌离子,氢离子在铜极上放电生成氢气,故C错误;
D、氯化铝是共价化合物,工业上是电解熔融的氧化铝的方法得到铝,故D错误;
故选A.
点评 本题考查原电池知识,侧重于原电池的组成和原理的考查,题目难度不大,C选项中注意原电池的正负极的判断以及原电池的工作原理的把握.

练习册系列答案
相关题目
15.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
| A. | ②③④ | B. | ①②③④ | C. | ①③④ | D. | ②③④⑤ |
16.下列关于氢键的说法正确的是( )
| A. | 由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3 | |
| B. | 氢键只能存在于分子间,不能存在于分子内 | |
| C. | 在固态水(冰)中,水分子间氢键数目增多,造成体积膨胀,密度减小,水的这种性质对水生生物的生存有重要意义 | |
| D. | 相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多 |
13.下列所采取的分离方法正确的是( )
| A. | 由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精 | |
| C. | 苯甲酸中含有少量氯化钠,可用重结晶的方法提纯得到苯甲酸 | |
| D. | 乙炔气体中混有少量硫化氢气体,可以通过足量溴水洗气除去 |
20.有5种元素X、Y、Z、Q、T.X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成化合物Y2Q3 | |
| B. | T和Z各有一种单质的空间构型为正四面体形 | |
| C. | X和Q结合生成的化合物为离子化合物 | |
| D. | ZO2是极性键构成的非极性分子 |
14.下列说法中错误的是( )
| A. | 符合通式CnH2n+2(n≥1)且相对分子质量不相等的有机物为同系物 | |
| B. | 符合同一通式且相对分子质量不相等的有机物为同系物 | |
| C. | 乙醇和甲醚不是同系物但是同分异构体 | |
| D. | CH3CH2CHO、CH2═CHCH2OH、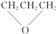 三种物质互为同分异构体 三种物质互为同分异构体 |
19.在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是:( )

| A. | 平衡时B的转化率为40% | |
| B. | 若再通入B,则再次达平衡时C的体积分数增大 | |
| C. | 在容器中加入催化剂,则B的转化率增大 | |
| D. | 若保持压强一定,当温度升高时,图中θ>45° |

 ;结构式⑥O=C=O.
;结构式⑥O=C=O. .
.