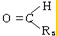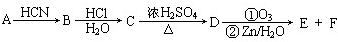题目内容
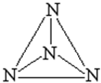 意大利科学家获得了极具研究价值的N4(分子结构如图所示),以下有关物质结构的说法正确的是( )
意大利科学家获得了极具研究价值的N4(分子结构如图所示),以下有关物质结构的说法正确的是( )| A、N均是以SP3杂化,N-N均为σ键 |
| B、N的电负性大于O,所以NH3的沸点低于H2O |
| C、N4为原子晶体,每个N的配位数为3 |
| D、N原子核外有5个未成对电子 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A、根据N4中价层电子对数判断;
B、同一周期从左到右,电负性逐渐增强;
C、N4晶体存在单个分子;
D、根据N原子的轨道排布式分析.
B、同一周期从左到右,电负性逐渐增强;
C、N4晶体存在单个分子;
D、根据N原子的轨道排布式分析.
解答:
解:A、由图可知N4中每个N形成3个共价键,还含有一对孤电子,则其价层电子对数为4,所以属于SP3杂化,N与N之间均为单键,即σ键,故A正确;
B、同一周期从左到右,电负性逐渐增强,所以N的电负性小于O,所以NH3中形成的氢键比H2O中氢键弱,则NH3的沸点低于H2O,故B错误;
C、N4晶体存在单个分子,属于分子晶体,不是原子晶体,N4中每个N与另外3个N形成共价键,所以配位数为3,故C错误;
D、N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道排布式为 ,所以N原子核外有3个未成对电子,故D错误;
,所以N原子核外有3个未成对电子,故D错误;
故选A.
B、同一周期从左到右,电负性逐渐增强,所以N的电负性小于O,所以NH3中形成的氢键比H2O中氢键弱,则NH3的沸点低于H2O,故B错误;
C、N4晶体存在单个分子,属于分子晶体,不是原子晶体,N4中每个N与另外3个N形成共价键,所以配位数为3,故C错误;
D、N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道排布式为
 ,所以N原子核外有3个未成对电子,故D错误;
,所以N原子核外有3个未成对电子,故D错误;故选A.
点评:本题N4为知识背景,考查了杂化类型的判断、电负性的比较、晶体类型的判断等,考查学生对所学知识的应用能力,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
几种短周期元素的原子半径及主要化合价如下表
下列说法正确的是( )
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、离子半径大小:r(M3+)>r(T2-) |
| B、R的氧化物对应的水化物不可能具有两性 |
| C、X单质在氧气中燃烧生成XO3 |
| D、L、T形成的简单离子核外电子数相等 |
反应:CaCl2+CO2+H2O=CaCO3+2HCl在任何情况下都不能发生反应,原因是该反应( )
| A、△H>0△S>0 |
| B、△H<0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S<0 |
下列仪器不能用酒精灯直接加热的是( )
| A、蒸馏烧瓶 | B、蒸发皿 |
| C、坩埚 | D、试管 |
下列关于胶体的叙述不正确的是( )
| A、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间 |
| B、胶体的分散质粒子可以通过滤纸孔隙,所以可以通过过滤操作分离溶液和胶体 |
| C、用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 |
| D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
下列物质中,所含氢原子的数目最大的是( )
| A、18g冰 |
| B、标准状况下22.4 L H2 |
| C、50g硫酸 |
| D、6.02×1023个氨分子 |
在一定条件下既能发生加成反应,也能发生取代反应,但不能使酸性KMnO4溶液褪色的是( )
| A、C2H5 OH |
| B、CH3CHO |
| C、C2H4 |
| D、C6H6 |
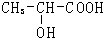
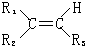
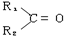 +
+