题目内容
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4mol/L,硫酸根离子浓度为0.7mol/L,则K+的物质的量浓度为 .如果A克某气体含有N个分子,那么B克该气体在标准状况下的体积约是 (NA表示阿伏加德罗常数的值).
考点:物质的量的相关计算,物质的量浓度的相关计算
专题:计算题
分析:根据溶液电荷守恒,则3c(Al3+)+c(K+)=2c(SO42-),据此计算c(K+);
计算Bg气体含有分子数目,根据n=
计算气体的物质的量,再根据V=nVm计算气体体积.
计算Bg气体含有分子数目,根据n=
| N |
| NA |
解答:
解:根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L;
A克某气体含有N个分子,那么B克该气体含有分子数目=
×N=
,故气体的物质的量=
=
mol,标况下该气体的体积=
mol×22.4L/mol=
L,
故答案为:0.2mol/L;
L.
A克某气体含有N个分子,那么B克该气体含有分子数目=
| Bg |
| Ag |
| NB |
| A |
| ||
| NAmol-1 |
| NB |
| ANA |
| NB |
| ANA |
| 22.4NB |
| ANA |
故答案为:0.2mol/L;
| 22.4NB |
| ANA |
点评:本题考查溶液物质的量浓度的计算、物质的量有关计算,题目难度不大,注意电解质混合溶液中常利用电荷守恒计算某一离子浓度.

练习册系列答案
相关题目
将过氧化钠固体粉末包在棉花团中,用导管往其中吹气,一会儿,棉花突然燃烧起来.下面有关该过程的说法错误的是( )
| A、该过程为放热过程 |
| B、该过程主要是口中吹过去的氧气把棉花氧化了 |
| C、该过程中CO2与过氧化钠发生了反应 |
| D、如果在包有过氧化钠粉末的棉花团中滴加少量水也可能燃烧起来 |
 如图所示,组成一个原电池.
如图所示,组成一个原电池.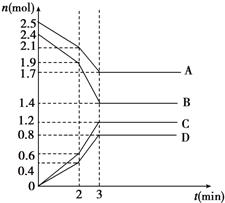 在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题:
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题: