题目内容
黑火药是中国的“四大发明”之一,会激励着我们奋发图强.黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S
K2S+N2↑+3CO2↑.该反应中,被氧化的元素是 ,氧化剂是 ,氧化产物是 反应中每转移6mol电子,可产生标准状况下 L CO2气体.
| ||
. |
考点:氧化还原反应
专题:氧化还原反应专题
分析:该方程式中,C元素化合价由0价变为+4价、S元素化合价由0价变为-2价、N元素化合价由+5价变为0价,根据元素化合价变化确定氧化剂、氧化产物,再结合转移电子和二氧化碳之间的关系式计算生成二氧化碳的体积.
解答:
解:该方程式中,C元素化合价由0价变为+4价、S元素化合价由0价变为-2价、N元素化合价由+5价变为0价,所以被氧化的元素是C,氧化剂是KNO3和S,氧化产物是CO2,反应中每转移6mol电子,可产生标准状况下 CO2气体体积=
×3×22.4L/mol=33.6L,
故答案为:C;KNO3和S;CO2;33.6.
| 6mol |
| 3×(4-0) |
故答案为:C;KNO3和S;CO2;33.6.
点评:本题考查了氧化还原反应,根据元素化合价变化及二氧化碳与转移电子之间的关系式计算,注意:该反应中氧化剂是两种,为易错点.

练习册系列答案
相关题目
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: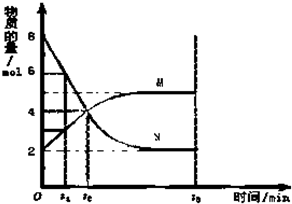 在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: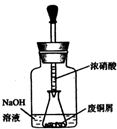 碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: 如图所示,组成一个原电池.
如图所示,组成一个原电池.