题目内容
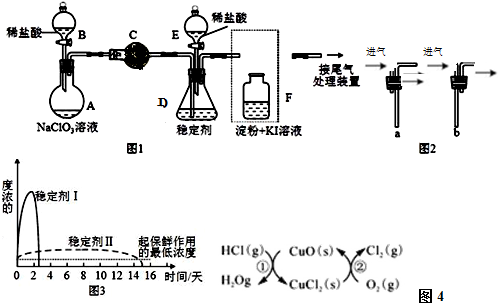
17.CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图1:
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气
(夹持仪器和加热装置省略).观察到的现象是试管内有棕色烟产生,
写出铜与氯气反应的化学方程式Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2.
(2)上述流程中固体K溶于稀盐酸的目的是避免Cu2+水解.
试剂X、固体J的物质最好分别为c.
a.NaOH Fe(OH)3b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+4H+.
(4)反应后,如图2盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该红褐色沉淀的主要化学式是Fe(OH)3.该腐蚀过程的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式Cu2++e-+Cl-=CuCl.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)铜在氯气中燃烧产生棕色氯化铜烟;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去;
(3)铜离子是氧化剂,SO2是还原剂,生成CuCl和SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极,正极发生还原反应,负极发生氧化反应,红褐色沉淀为氢氧化铁,正极上ClO-得电子生成Cl-;
(5)Cu2+在阴极上得电子,铜元素的化合价可以降至+1价、0价,部分CuCl析出是Cu2+得到电子生成CuCl,结合电荷守恒配平书写电极反应.
解答 解:(1)铜在氯气中燃烧生成固体氯化铜,观察到棕黄色的烟,反应为:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2,
故答案为:试管内有棕色烟产生;Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:避免Cu2+水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+4H+;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极.负极的电极反应式为Fe-2e-=Fe2+,Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,正极的电极反应式为ClO-+2e-+H2O=Cl-+2OH-,红褐色沉淀为氢氧化铁,
故答案为:Fe(OH)3;ClO-+2e-+H2O=Cl-+2OH-;
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,电极反应为:Cu2++e-+Cl-=CuCl,
故答案为:Cu2++e-+Cl-=CuCl.
点评 本题以实验室制备氯化铜为背景,考查了物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| A. | pH<7的溶液一定是酸溶液 | |
| B. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na十) | |
| C. | 在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(C1-) | |
| D. | 0.1 mol•L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| A. | NA个氧气分子的体积约为11.2L | |
| B. | 1.8g的NH4+离子中含有的电子数为10NA | |
| C. | 标准状况下,2.24 L氢气和氧气以任意比组成的混合气体,所含的原子数约为0.2NA | |
| D. | 7.8g过氧化钠固体中含有的阴、阳离子的总数约为0.4 NA |
| A. | 石油分馏实验 | B. | 乙醇脱水实验 | C. | 制溴苯 | D. | 苯的硝化实验 |
| A. | 充电时电池反应为FePO4+Li═LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的负极相连 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 放电时,在正极上是Li+得电子被还原 |
 .某油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
.某油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
 ”结构.
”结构.
 ;X元素基态原子的电子排布式为1s22s22p63s23p5.
;X元素基态原子的电子排布式为1s22s22p63s23p5.