题目内容
2.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | NA个氧气分子的体积约为11.2L | |
| B. | 1.8g的NH4+离子中含有的电子数为10NA | |
| C. | 标准状况下,2.24 L氢气和氧气以任意比组成的混合气体,所含的原子数约为0.2NA | |
| D. | 7.8g过氧化钠固体中含有的阴、阳离子的总数约为0.4 NA |
分析 A、氧气所处的状态不明确;
B、求出铵根离子的物质的量,然后根据1mol铵根离子中含10mol电子来分析;
C、标况下2.24L混合气体的物质的量为0.1mol,而氢气和氧气均为双原子分子;
D、求出过氧化钠的物质的量,然后根据过氧化钠中含2个钠离子和1个过氧根来分析.
解答 解:A、氧气所处的状态不明确,故其体积无法计算,故A错误;
B、1.8g铵根离子的物质的量为0.1mol,而1mol铵根离子中含10mol电子,故0.1mol铵根离子中含1mol电子即NA个,故B错误;
C、标况下2.24L混合气体的物质的量为0.1mol,而氢气和氧气均为双原子分子,故0.1mol混合气体中含0.2NA个原子,故C正确;
D、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠中含2个钠离子和1个过氧根,故0.1mol过氧化钠中含0.2mol钠离子和0.1mol过氧根即共0.3mol离子即0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
12.在密闭容器中发生反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡浓度的1.2倍.下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向逆反应方向移动 | ||
| C. | D的体积分数变大 | D. | a+b>c+d |
13.下列叙述不正确的是( )
| A. | 丁达尔效应可以区别溶液和胶体 | |
| B. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| C. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 | |
| D. | 向品红溶液中通入SO2气体红色褪去,再加热恢复红色 |
7.某温度时,在容积为2L的三个恒容密闭容器中发生反应3A(g)+B(g)?xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3mol A,2mol B | 6molA.4mol B | 2mol C |
| 达到平衡的时间/时间 | 5 | 8 | |
| A的平衡浓度/mol•L-1 | c1 | c2 | |
| C的体积分数/% | ω1 | ω2 | ω3 |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若x>4,2c1<c2 | |
| B. | 若x=4,则ω1=ω2=ω3 | |
| C. | 只有当x=4时,2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长 |
14.可以将五种无色液体:C2H5OH、AgNO3溶液、C2H5Br、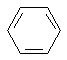 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )
 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )| A. | FeCl2溶液 | B. | NaOH溶液 | C. | 水 | D. | 溴水 |
11. (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为2.24L.
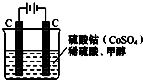
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
 CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空:
CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空: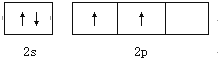 .
. ;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大. 