题目内容
7.下列离子方程式书写正确的是( )| A. | 向FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Ba(OH)2溶液与硫酸反应:OH-+H+═H2O | |
| C. | 次氯酸钙溶液中通入少量SO2:2ClO-+Ca2++SO2+H2O═CaSO3↓+2HClO | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.电子、电荷不守恒;
B.漏写生成硫酸钡的离子反应;
C.发生氧化还原反应生成硫酸钙;
D.碳酸氢钠完全反应,生成碳酸钙、水、NaOH.
解答 解:A.向FeCl2溶液中通入Cl2的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故A错误;
B.Ba(OH)2溶液与硫酸反应的离子反应为SO42-+Ba2++2OH-+2H+═2H2O+BaSO4↓,故B错误;
C.次氯酸钙溶液中通入少量SO2的离子反应为2ClO-+Ca2++SO2+H2O═CaSO4↓+Cl-+H++HClO,故C错误;
D.碳酸氢钠溶液中加入过量石灰水的离子反应为HCO3-+Ca2++OH-═CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
18.不属于金属通性的是( )
| A. | 延展性 | B. | 高熔点 | C. | 导热性 | D. | 导电性 |
15.关于测定1mol氢气体积的操作中,错误的是( )
| A. | 先检查装置的气密性 | |
| B. | 镁带用砂纸擦去表面的氧化层后称量 | |
| C. | 反应结束后立即读取气体体积 | |
| D. | 加入过量稀硫酸以确保镁带完全反应 |
2.下列仪器适合用于萃取分液的是( )
| A. |  | B. |  | C. |  | D. |  |
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L H2中所含质子数、中子数均为2NA | |
| B. | 32g O2气体和32g O3气体的分子数之比为3:2 | |
| C. | 1L 1mol•L-1的盐酸中所含粒子总数为2NA | |
| D. | 71g氯气与足量铁粉充分反应,转移的电子数为3NA |
1.绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是( )


| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与0.8 molNaOH反应 | |
| C. | 能发生取代反应和消去反应 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
2.碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑(未配平)
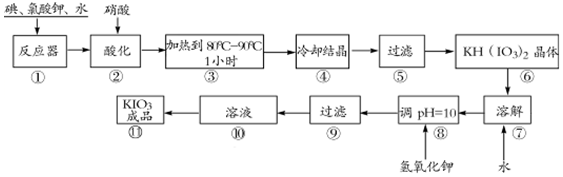
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)步骤②中,用稀酸酸化的作用是促进氯气从反应混合物中逸出;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2能将KIO3氧化成KIO4;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是蒸发浓缩、冷却结晶.

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)步骤②中,用稀酸酸化的作用是促进氯气从反应混合物中逸出;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2能将KIO3氧化成KIO4;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是蒸发浓缩、冷却结晶.
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
