题目内容
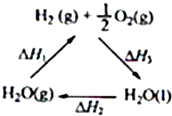 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ② |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 | ||
| B、该过程实现了太阳能向化学能的转化 | ||
| C、图中△H1=△H2+△H3 | ||
D、H2(g)+
|
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:A、根据题干反应方程式写出总反应:H2O+CO2→H2+CO+O2,反应中CeO2没有消耗;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO;
C、根据盖斯定律及图中转化关系进行分析;
D、原电池中负极失去电子发生氧化反应.
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO;
C、根据盖斯定律及图中转化关系进行分析;
D、原电池中负极失去电子发生氧化反应.
解答:
解:A、通过太阳能实现总反应H2O+CO2→H2+CO+O2可知:CeO2没有消耗,CeO2为催化剂,故A正确;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,故B正确;
C、由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,故C错误;
D、①H2(g)+
O2(g)=H2O(l)△H3;②H2O(l)=H2O(g)△H2,根据盖斯定律①+②得:H2(g)+
O2(g)=H2O(g)△H=△H3+△H2;因②△H、△H3都小于0,而△H2大于0,故△H>△H3,故D错误;
故选CD.
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,故B正确;
C、由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,故C错误;
D、①H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
故选CD.
点评:本题考查了原电池原理、盖斯定律的应用及催化剂的判断,题目难度中等,注意明确盖斯定律的含义及利用盖斯定律求算反应热的方法,明确原电池工作原理.

练习册系列答案
相关题目
电解之前食盐水需要精制,除去粗盐中Ca2+,Mg2+,SO42-的等杂质离子,使用的试剂有:①NaOH ②BaCl2 ③HCl ④Na2CO3,其加入的顺序合理的是( )
| A、①③④② | B、①②④③ |
| C、③②④① | D、①②③④ |
在一个体积不变的密闭容器中,盛有等物质的量的SO2、O2、SO3(气)的混合气体,在一定温度和压强下,反应达平衡时,容器中混合气体的密度比反应前减少了
(温度、压强反应前后不变),则反应达平衡时,混和气体中SO2占总体积的( )
| 1 |
| 13 |
A、
| ||
B、
| ||
C、
| ||
D、
|
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列有关说法不正确的是( )
| A、产物乙酸乙酯存在18O |
| B、产物水中存在18O |
| C、反应中加入浓硫酸作催化剂 |
| D、此反应属于取代反应 |