题目内容
(1)已知下列热化学方程式:
Ⅰ.2H2(g)+O2 (g)=2H2O(l);△H=-570kJ?mol-1
Ⅱ.2H2(g)+O2 (g)=H2O(g);△H=-483.6kJ?mol-1
Ⅲ.2C(s)+O2 (g)=2CO(g);△H=-221kJ?mol-1
Ⅳ.C(s)+O2 (g)=CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
①H2的燃烧热为 ;
②写出CO燃烧的热化学方程式 .
(2)已知含有1molH2SO4的稀溶液与足量的NaOH稀溶液反应放出114.6KJ的热量.写出表示该中和热的热化学方程式: ;
(3)若用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”).
Ⅰ.2H2(g)+O2 (g)=2H2O(l);△H=-570kJ?mol-1
Ⅱ.2H2(g)+O2 (g)=H2O(g);△H=-483.6kJ?mol-1
Ⅲ.2C(s)+O2 (g)=2CO(g);△H=-221kJ?mol-1
Ⅳ.C(s)+O2 (g)=CO2(g);△H=-393.5kJ?mol-1
回答下列问题:
①H2的燃烧热为
②写出CO燃烧的热化学方程式
(2)已知含有1molH2SO4的稀溶液与足量的NaOH稀溶液反应放出114.6KJ的热量.写出表示该中和热的热化学方程式:
(3)若用相同浓度和体积的氨水(NH3?H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
考点:用盖斯定律进行有关反应热的计算,反应热和焓变
专题:化学平衡专题
分析:(1)①燃烧热是指在25摄氏度,101 kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量为1mol,产物必须是稳定氧化物据此解答;
②结合盖斯定律计算得到,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(3)根据弱电解质电离吸热分析.
②结合盖斯定律计算得到,燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
(3)根据弱电解质电离吸热分析.
解答:
解:(1)①根据燃烧热的定义,1mol氢气燃烧生成液态水更稳定,所以①H2(g)+
O2(g)=H2O(l);△H=-285kJ?mol-1;为氢气燃烧热的化学方程式,所以氢气的燃烧热为:285kJ?mol-1;
故答案为:285kJ?mol-1;
②已知:③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1;
依据盖斯定律④-③×
得到CO(g)+
O2(g)=CO2(g)△H=(-393.5kJ/mol)-
×(-221kJ/mol)=-283KJ/mol;
故答案为:CO(g)+
O2(g)=CO2(g)△=-283KJ/mol.
(2)1mol H2SO4溶液与足量 NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-114.6kJ/mol,
中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(3)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,求得的中和热数值将会减小,
故答案为:偏小.
| 1 |
| 2 |
故答案为:285kJ?mol-1;
②已知:③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1;
④C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1;
依据盖斯定律④-③×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CO(g)+
| 1 |
| 2 |
(2)1mol H2SO4溶液与足量 NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-114.6kJ/mol,
中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
(3)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,求得的中和热数值将会减小,
故答案为:偏小.
点评:本题考查了燃烧热、中和热的定义和反应热的求算,题目难度不大,理解燃烧热概念时注意可燃物物质的物质的量必须是1mol且生成稳定的氧化物,中和热是生成1mol水.

练习册系列答案
相关题目
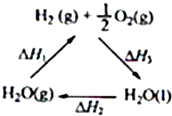 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ② |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 | ||
| B、该过程实现了太阳能向化学能的转化 | ||
| C、图中△H1=△H2+△H3 | ||
D、H2(g)+
|
在容积相同的甲、乙两个密闭容器中,分别充入1mol N2、3mol H2,使它们在温度相同的条件下反应,并达到平衡.若甲容器保持体积不变,乙容器保持压强不变,平衡时甲容器中N2的转化率为10%,则乙容器中N2的转化率为( )
| A、10% | B、大于10% |
| C、小于10% | D、5% |
已知:
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ/mol
②NH3(g)=NH3(aq)△H2=-35.1kJ/mol
③HCl(g)=HCl(aq)△H3=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H4=-52.3kJ/mol
则反应NH4Cl(s)=NH4Cl(aq)的△H5为( )
①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ/mol
②NH3(g)=NH3(aq)△H2=-35.1kJ/mol
③HCl(g)=HCl(aq)△H3=-72.3kJ/mol
④NH3(aq)+HCl(aq)═NH4Cl(aq)△H4=-52.3kJ/mol
则反应NH4Cl(s)=NH4Cl(aq)的△H5为( )
| A、+16.3 kJ/mol |
| B、-16.3 kJ/mol |
| C、+335.7 kJ/mol |
| D、-335.7 kJ/mol |
在实验室中进行蒸发和过滤操作,都要用到的仪器是( )
| A、烧杯 | B、蒸发皿 |
| C、酒精灯 | D、玻璃棒 |
关于乙烯用途的下列说法中,不正确的是( )
| A、制造塑料 | B、制乙醇 |
| C、作燃料 | D、作果实催熟剂 |
为海底作业提供氧气的物质是( )
| A、KClO3 |
| B、KMnO4 |
| C、Na2O2 |
| D、H2O |
