题目内容
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为 (填序号) a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”).
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为 ,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”).
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的如图装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→ → → → → → →h
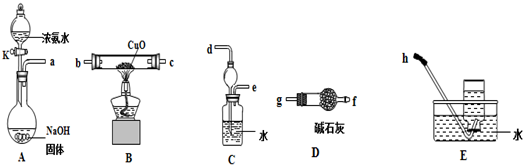
①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是 .
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为 .
③装置C中的球形装置的作用是 .
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的如图装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→

①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为
③装置C中的球形装置的作用是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)证明Al(OH)3呈两性的试剂是强酸和强碱,要想证明Cu(OH)2呈两性,也必须选强酸和强碱溶液;
(2)①根据氧化还原反应,氧化铜作氧化剂和还原剂,得电子生成氧化亚铜,失电子生成氧气,所以反应物是氧化铜,生成物是氧化亚铜和氧气,反应条件是高温,所以方程式为:4CuO
2Cu2O+O2↑,物质由不稳定物质转化为稳定物质的倾向,所以在高温条件下,十l价的Cu比十2价Cu更稳定;
②物质由不稳定物质转化为稳定物质的倾向,所以在酸性溶液中,+1价Cu比+2价Cu更不稳定;
(3)①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,据此分析可能原因;
②根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
③氨气极易溶于水,容易发生倒吸现象,使用球形漏斗可以防止倒吸现象.
(2)①根据氧化还原反应,氧化铜作氧化剂和还原剂,得电子生成氧化亚铜,失电子生成氧气,所以反应物是氧化铜,生成物是氧化亚铜和氧气,反应条件是高温,所以方程式为:4CuO
| ||
②物质由不稳定物质转化为稳定物质的倾向,所以在酸性溶液中,+1价Cu比+2价Cu更不稳定;
(3)①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,据此分析可能原因;
②根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
③氨气极易溶于水,容易发生倒吸现象,使用球形漏斗可以防止倒吸现象.
解答:
解:(1)证明Al(OH)3呈两性的试剂是强酸和强碱,因此要想证明Cu(OH)2呈两性,也必须选强酸和强碱溶液,硫酸是强酸,所以可以选取;氢氧化钠是强碱,所以可选取;氨水是弱碱,醋酸是弱酸,均不能选择,所以bc正确,
故答案为:bc;
(2)①物质都有由不稳定状态转化为稳定状态的倾向,所以根据CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末可知,在高温条件下,+l价的Cu比+2价Cu更稳定,
故答案为:稳定;
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,这说明氧化亚铜和稀硫酸反应生成的是硫酸铜、水和单质铜,因此该反应的离子化学方程式为:Cu2O+2H+=Cu2++Cu+H2O,这说明在酸性溶液中,+1价Cu比+2价Cu更不稳定,
故答案为:Cu2O+2H+=Cu2++Cu+H2O;不稳定;
(3)A装置是制备氨气的,生成的氨气中含有水蒸气,需要通过碱石灰干燥.又因为氨气极易溶于水,过量的氨气在进行尾气处理时需要防止倒吸,所以正确的连接顺序为:a→g→f→b→c→d→e→h,
故答案为:g;f;b;c;d;e;
①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,即:可能的原因是没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔),
故答案为:没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔);
②实验结束后,装置B中固体由黑色变为红色,这说明有导致铜生成,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,因此钙气体应该是氮气,所以B装置中发生的化学方程式为3CuO+2NH3
3Cu+N2+3H2O,
故答案为:3CuO+2NH3
3Cu+N2+3H2O;
③由于氨气极易溶于水,直接通入水中吸收,容易倒吸,所以装置C中的球形装置的作用是防倒吸,故答案为:防倒吸.
故答案为:bc;
(2)①物质都有由不稳定状态转化为稳定状态的倾向,所以根据CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末可知,在高温条件下,+l价的Cu比+2价Cu更稳定,
故答案为:稳定;
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,这说明氧化亚铜和稀硫酸反应生成的是硫酸铜、水和单质铜,因此该反应的离子化学方程式为:Cu2O+2H+=Cu2++Cu+H2O,这说明在酸性溶液中,+1价Cu比+2价Cu更不稳定,
故答案为:Cu2O+2H+=Cu2++Cu+H2O;不稳定;
(3)A装置是制备氨气的,生成的氨气中含有水蒸气,需要通过碱石灰干燥.又因为氨气极易溶于水,过量的氨气在进行尾气处理时需要防止倒吸,所以正确的连接顺序为:a→g→f→b→c→d→e→h,
故答案为:g;f;b;c;d;e;
①由于反应中由氨气生成,烧瓶内压强大,导致氨水不能滴下,即:可能的原因是没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔),
故答案为:没有将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽(或小孔)对准漏斗上的小孔);
②实验结束后,装置B中固体由黑色变为红色,这说明有导致铜生成,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,因此钙气体应该是氮气,所以B装置中发生的化学方程式为3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
③由于氨气极易溶于水,直接通入水中吸收,容易倒吸,所以装置C中的球形装置的作用是防倒吸,故答案为:防倒吸.
点评:本题探究了Cu的常见化合物的性质,主要考查了性质实验方案的设计,题目难度中等,采用假设的方法判断铜的常见化合物的性质,然后作实验验证;要注意有毒气体产生时,一定有尾气处理装置,不能直接排空,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
对于反应2SO2(g)+O2(g)?2SO3(g),能增大正反应速率且提高O2的转化率的措施是( )
| A、移去部分SO3 |
| B、降低体系温度 |
| C、通入大量O2 |
| D、通入大量SO2 |
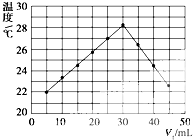 将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1 mL 1.00mol?L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A、做该实验时环境温度为22℃ |
| B、该实验表明所有化学反应化学能只转化为热能 |
| C、NaOH溶液的浓度为1.50 mol?L-1 |
| D、该实验表明有水生成的反应都是放热反应 |
下列叙述正确的是( )
| A、由于Ksp(BaSO4)=1.1×10-10小于Ksp(BaCO3)=5.1×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C、除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
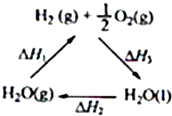 某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?xCe+xH2O+xCO2
| 900℃ |
| ② |
下列说法不正确的是( )
| A、该过程中CeO2没有消耗 | ||
| B、该过程实现了太阳能向化学能的转化 | ||
| C、图中△H1=△H2+△H3 | ||
D、H2(g)+
|
